Человеческий глаз является по многим причинам уникальным органом. Дело не только в сложнейших механизмах, обеспечивающих преломление и прохождение света, его восприятие и первичный анализ зрительной информации, но и в тех барьерах, которые отграничивают глаз от организма и разделяют его части между собой. Будучи производным мозга, глаз также является иммунопривилегированным органом, а гематоретинальный барьер работает по тем же принципам, что и гематоэнцефалический. Помимо этого, передняя и задняя камеры глаза, заполненные внутриглазной жидкостью, отграничены от стекловидного тела хрусталиком, его капсулой и передней гиалоидной мембраной, что также ограничивает обмен между передней и задней частями глаза [1].
Но эти же барьеры, защищающие внутренние структуры глаза от токсинов, бактерий и даже собственной иммунной системы, создают проблемы в случае развития различных заболеваний глаза. Как быть, если терапевтический агент не проходит сквозь гематоретинальный барьер или концентрация, необходимая для эффективного воздействия на структуры глаза, становится токсичной для остального организма?
Первые опыты введения каких-либо субстанций внутрь глаза начались еще в девятнадцатом – начале двадцатого века. Изначально этот метод был направлен на лечение отслойки сетчатки и внутриглазных кровоизлияний. Таким образом в те годы немецкий врач Дойчманн вводил в глаз экстракт стекловидного тела кролика [2], а его коллега Ом при помощи вводимого в глаз воздуха пытался вернуть на место отслоившуюся сетчатку [3].

Рисунок 2 | Заголовок одной из первых в мире статей, посвященных интравитреальным инъекциям
В последующие десятилетия исследователи ограничивались введением в глаз воздуха или физраствора. В 1940-х годах были опыты введения пенициллина для лечения эндофтальмита (гнойного воспаления глазного яблока), но те же авторы позже предпочли использовать системное и субконъюнктивальное введение препарата вместо инъекций в глаз. Интерес к методике возрос в 1960-е с открытием газовых смесей, которые могли длительное время оставаться внутри глаза, с целью лечения отслойки сетчатки. Новый скачок начался в 1970-е с изучением физиологии гематоретинального барьера. Понимание механизмов работы этого барьера позволило начать использовать антибиотики для лечения эндофтальмита (уже намного более осознанно, чем в 1940-е) и стероидные препараты для лечения воспалительных заболеваний в обход существующих анатомических барьеров. Вскоре в арсенал офтальмологов был добавлен целый спектр препаратов вплоть до противовирусных и противоопухолевых, которые стало возможным вводить внутрь глаза [4].
Настоящей революцией явилось открытие моноклональных антител, направленных против фактора роста эндотелия сосудов (VEGF) в 2000-е годы [4]. Этот совершенно новый тип препаратов оказалось возможным вводить внутрь глаза, чтобы в дальнейшем останавливать рост новообразованных сосудов при диабетической ретинопатии, влажной форме возрастной макулярной дегенерации, тромбозах центральной вены сетчатки, субретинальной неоваскулярной мембране и других патологиях. Это привело к взрывному росту применения данной методики, и уже в 2006 году в системе Medicare только в США было зарегистрировано 325 000 инъекций [4], тогда как с 1997 по 2001 годы по всему миру делалось не более 5000 инъекций в год [5]. В 2007 в США было сделано уже 800 000 инъекций, а в 2016 — 5,9 миллионов [5]. Такой взрывной рост был обусловлен высокой эффективностью данного способа лечения очень распространенных возрастной макулярной дегенерации и диабетической ретинопатии, а также относительной безопасностью самой методики. Это был буквально сдвиг парадигмы в лечении, что не так часто наблюдается в медицине.
В своей серии заметок «Ophthalmic Pearls» Американская академия офтальмологии дает следующие рекомендации по подготовке к проведению интравитреальных инъекций [6]:
Инъекция осуществляется через pars plana цилиарного тела внутрь полости стекловидного тела. Для этого необходимо отступить на 3–3,5 мм кзади от лимба в случае афакичного (хрусталик отсутствует) или псевдофакичного (установлен искусственный хрусталик) глаза либо на 3,5–4 мм кзади от лимба в случае факичного глаза (присутствует нативный хрусталик). Эта зона достаточно безопасна для инъекции как с точки зрения низкого риска кровоизлияния, так и с точки зрения возможной травмы сетчатки. Категорически недопустимо проведение инъекции в области pars plicata цилиарного тела, поскольку там находится большое количество кровеносных сосудов, что незамедлительно приведет к кровоизлиянию. Инъекция, как правило, осуществляется в нижневисочном квадранте, хотя может быть использована и другая зона. Выбор именно такого расположения связан с минимизацией влияния на зрительную ось. Пациент при этом должен смотреть в сторону, противоположную месту инъекции, в течение всей манипуляции [4–6, 8].

Рисунок 3 | Трехмерная модель переднего отрезка глазного яблока, сделанная на основе данных рентгеновской микротомографии. По материалам [7].
Иглу необходимо направить в сторону средней части стекловидного тела скосом кверху, а вводить вещество необходимо крайне медленно, чтобы избежать формирования струи или кавитационного потока. Иглу не следует вводить в область инъекции до конца, что связано с уменьшением риска травматизации структур глаза, особенно в случае движения глазных яблок. После введения раствора в склеру иглу поворачивают к центру глазного яблока и осторожно вводят раствор в полость среднего стекловидного тела одним плавным непрерывным движением. Затем иглу извлекают, а место инъекции сразу же закрывают стерильным ватным тампоном, чтобы предотвратить рефлюкс [4].
Вот уже много лет активно ведутся дискуссии, где проводить подобную инъекцию — в операционной либо в кабинете офтальмолога (in office), в первую очередь из-за опасений развития бактериального эндофтальмита как самого грозного осложнения инъекции [8]. С одной стороны, логично предположить, что в условиях операционной риски меньше из-за стерильности. С другой, при должном соблюдении правил асептики и антисептики риски эндофтальмита в случае выполнения процедуры in office примерно так же низки, как и в условиях операционной. Мало того, результат большого мета-анализа, опубликованный в журнале «JAMA Ophthalmology», показал, что значимой разницы в плане риска развития осложнений между выполнением инъекции в условиях операционной и в кабинете врача нет [9]. При условии соблюдения всех мер асептики и антисептики, разумеется. Тем не менее, стоит понимать, что в операционной изначально более строгий контроль чистоты, нежели в кабинете врача.
К задачам анестезии при интравитреальной инъекции относят [8]:
Контаминация области интравитреальной инъекции микрооорганизмами происходит из-за распространения резидентных бактерий, обитающих на веках пациента либо на слизистой полости рта (причем на слизистой рта не только пациента, но и лечащего врача, который разговаривает с пациентом) [5]. Последний факт был подтвержден многочисленными исследованиями, в том числе теми, где испытуемые зачитывали текст перед культуральными средами в чашках Петри, имитирующих пациента, находящегося в различных положениях [11]. По этой причине рекомендуется закрывать операционное поле стерильной клеенкой с вырезом под глаза, а врачу носить хирургическую маску. Это в дополнение к применению антисептиков значительно снижает риск эндофтальмита [12]. Тем не менее, использование клеенки для пациента, судя по всему, является опциональным [5, 13]. В том числе это связано с тем, что многие пациенты отмечают сильный дискомфорт и даже страх при закрытии их лица клеенкой [13]. Кроме того, рекомендуется меньше говорить в операционной или в кабинете в процессе подготовки и выполнения инъекции, особенно в том случае, если персоналом не используются маски [5, 13]. Вопрос пользы или даже вреда от ношения пациентами масок оказался настолько противоречивым, что будет разобран далее отдельно. Что касается стерильных перчаток, то в настоящее время не была доказана связь между их ношением и снижением рисков эндофтальмита [5, 13]. Очевидной (но важной) рекомендацией является тщательное мытье рук согласно всем правилам асептики и антисептики перед выполнением процедуры вне зависимости от того, используются ли стерильные перчатки [13].
В настоящий момент наиболее распространенным антисептиком для предоперационной подготовки окружающих мягких тканей и поверхности глаза является повидон-йод. Такое распространение связано с тем, что он обладает широким спектром микробицидной активности (уничтожает как бактерии и вирусы, так и споры грибков), а также не было отмечено случаев резистентности. Помимо этого, не было отмечено случаев анафилаксии и какого-либо повреждения тканей глаза. Нанесение 5 %-ного раствора повидон-йода на 30 секунд считается достаточным для микробицидного действия. В редких случаях наблюдается индивидуальная непереносимость повидон-йода либо каких-либо компонентов раствора, которая проявляется раздражением поверхностных структур глаза. Альтернативой повидон-йоду в этом случае является водный (!) раствор хлоргексидина биглюконата. Использование спиртового раствора категорически недопустимо из-за токсического действия на роговицу и другие ткани глаза [5].
Применение же антибиотиков для предоперационной подготовки, судя по всему, не только бесполезно, но и вредно. Во-первых, оно никак не снижает риск развития эндофтальмита, согласно проведенным исследованиям, а во-вторых, ведет к формированию резистентных штаммов микроорганизмов [5].
Выбор правильного диаметра и длины иглы важен не только для комфорта пациента, но и для безопасной процедуры инъекции и эффективности лечения. Наиболее часто используемые калибры игл варьируются от 27-го до 30-го калибра. Помимо этого, часто также используют иглы вплоть до 33-го калибра [5]. В настоящее время не существует единого мнения об идеальном калибре игл для интравитреальных инъекций. Тем не менее, лабораторные данные показывают, что использование игл 30-го калибра может уменьшить рефлюкс и ущемление стекловидного тела [14]. Если говорить о длине иглы, то согласно рекомендациям, она составляет от 14 до 18 мм [5].
В настоящий момент нет единого мнения о необходимости расширения зрачка перед выполнением интравитреальной инъекции, однако это может быть полезным для начинающих врачей, так как позволяет незамедлительно оценить перфузию сосудов сетчатки сразу после интравитреальной инъекции [5].
Нередко бывает так, что пациенту требуется инъекция препарата в оба глаза, но возмозможность выполнения билатеральной инъекции в один день остается дискуссионной [5]. Исследование по типу случай-контроль с вовлечением пациентов, нуждающихся в двустороннем введении анти-VEGF препаратов, показало, что большинство пациентов предпочитали двусторонние инъекции, выполняемые в один и тот же день [15]. Другим аспектом, помимо удобства для пациентов, является экономическая эффективность для лечебного учреждения [16]. Тем не менее, рекомендуется взвесить все риски, чтобы избежать потенциальных осложнений, таких как двусторонний эндофтальмит. Согласно данным текущей литературы, двусторонняя интравитреальная инъекция, выполняемая в один и тот же день, кажется обычной процедурой. Рекомендуется обрабатывать каждый глаз последовательно, используя новую пару перчаток и отдельные стерильные инструменты, такие как векорасширители [5].
Существует три основных положения иглы при выполнении интравитреальной инъекции: перпендикулярный (прямой), косой и двухплоскостной (туннельный) (рис. 4). В относительно недавнем проспективном исследовании сравнивалось влияние способа на кратковременные изменения внутриглазного давления (ВГД), рефлюкс стекловидного тела и другие осложнения [17]. Было выявлено, что двухплоскостной способ не отличается от других в плане осложнений. Более того, в других исследованиях было определено, что рефлюкс стекловидного тела был существенно ниже именно в случае двухплоскостного способа введения [18, 19].

Рисунок 4 | Схематическое изображение трех различных техник проникновения иглы
(А) перпендикулярно или прямо, (В) косо, (С) в двух плоскостях с созданием туннеля.
В последнем способе перфорируют склеру под углом 15–30 °, а затем иглу перемещают на 45–60 °. При этом игла все еще находится внутри склеры. Такой маневр создает туннель в двух отдельных плоскостях. После этого вводят препарат, а затем извлекают иглу под углом 90 °.
Схема взята из [8].
После нанесения повидон-йода или другого антисептика необходимо не допустить контакта век и ресниц с местом инъекции или шприцом. Лучшим способом для этого является установка стерильного векорасширителя, однако допускается использовать и другие методы, в том числе мануальное расширение век [5, 13].
Интравитреальное введение лекарственных средств может приводить к временному повышению ВГД (в англоязычной литературе используют термин IOP-spike для этого явления). Как правило, в клинической практике лекарственные средства вводят в объеме от 0,025 до 0,1 мл. Хотя этот объем равен всего лишь 1–2 % от объема стекловидного тела, это приводит как к кратковременному (в большинстве случаев), так и к долговременному повышению ВГД [5].
Однако повышение внутриглазного давления обусловлено не только объемом введенного лекарства, но и его свойствами [5]. Среди препаратов, которые могут провоцировать повышение ВГД, стоит отметить стероиды. Частота этого явления, как сообщается, составляет от 30 до 60 % после интравитреального введения триамцинолона ацетонида [20] и от 30 до 50 % — после использования дексаметазоновых имплантатов (Ozurdex®) [21]. Анти-VEGF препараты также могут вызывать повышение ВГД в 12 % случаев [5]. Было предложено несколько механизмов этого побочного эффекта, включая токсические изменения, транзиторное воспаление с продукцией цитокинов, которые способствуют повышению ВГД, и механическую блокаду трабекулярной сети [22, 23].
В большинстве случаев повышение ВГД либо преходящее, либо его легко контролировать с помощью местного лечения [16–18]. Однако как краткосрочное, так и долгосрочное повышение ВГД нежелательно, особенно у пациентов, у которых имеется глаукома. Таким образом, при выполнении инъекции важно уточнить наличие офтальмогипертензии или глаукомы и тщательно контролировать ВГД у таких пациентов.
Снижение ВГД перед выполнением интравитреальной инъекции, как правило, не требуется, но может быть использовано у пациентов с прогрессирующей глаукоматозной нейропатией зрительного нерва и у тех, у кого высок риск длительного постинъекционного скачка ВГД, а также у тех, у кого любой скачок ВГД может привести к поражению чувствительных структур глаза, таких как зрительный нерв [13]. Помимо пальцевого массажа, для снижения ВГД могут быть использованы такие классические препараты для лечения глаукомы, как бримонидин или тимолол. Другим способом является создание парацентеза в роговице, чтобы выпустить немного водянистой влаги [5, 13]. Эти меры, выполненные до интравитреальной инъекции, статистически значимо снижают ВГД после самой инъекции [5].
Важно отметить, что любая степень предшествующей глазной гипертензии или глаукомы не является противопоказанием для интравитреальной инъекции. Поскольку конечной целью является сохранение зрения, эти патологические состояния необходимо лечить одновременно с заболеванием, которое потребовало интравитреального введения препарата [5].
Вокруг того, нужно ли пациентам носить хирургические маски, в последние годы развернулась нешуточная дискуссия. Если раньше, до пандемии COVID-19, в статьях и рекомендациях склонялись к тому, что это может быть как минимум полезным в плане снижения распространения бактерий из полости рта пациента в область инъекции [5, 8, 13], то после того, как маски стали буквально вездесущими и обязательными в том числе для пациентов [24], стали появляться и противоположные этому суждения.
В нашумевшем исследовании, опубликованном в 2020 году, при помощи инфракрасной камеры отслеживали распределение потоков воздуха в зависимости от типа масок (маски на завязках, маски на резинках и респираторы типа N95). Было обнаружено, что использование масок в 91 % случаев приводит к изменению направления потоков воздуха в сторону глаз [25].
В дальнейшем норвежские исследователи опубликовали короткую заметку о том, что случаев эндофтальмита в стенах Университетской клиники Осло стало больше по сравнению с допандемийными временами, что авторы связали с обязательным ношением масок [26]. Тем не менее, пока эти данные не были подтверждены [27], в том числе в ходе многоцентровых исследований [28].
Тем не менее, можно задаться вопросом: если все носят маски, и они не приводят к более частому развитию эндофтальмита, может быть, ношение пациентом маски снижает риски развития данного осложнения, как было предположено ранее? Оказалось, что нет, — обязательное ношение масок не привело к тому, что случаев развития эндофтальмита стало меньше за последние два года [29]. Разумеется, это еще только предварительные данные, но, тем не менее, уже можно говорить о том, что целесообразность ношения масок пациентами является достаточно спорной.
Подведем итоги в виде небольшой таблицы, где суммированы рекомендации относительно проведения интравитреальных инъекций.

Разумеется, как и у любого другого медицинского вмешательства (а интравитреальная инъекция, безусловно, является вмешательством, причем почти хирургическим), при интравитреальной инъекции могут быть осложнения. Самым грозным из них является эндофтальмит, однако шанс его развития находится буквально на уровне статистической погрешности и составляет 0,032 % (3,2 случая на 10 000 инъекций) [29]. Такая низкая частота встречаемости связана с тем, что это очень грозное осложнение легко предотвратить при должном соблюдении всех мер асептики и антисептики. Другим осложнением, связанным непосредственно с методикой, является разрыв или отслойка сетчатки. Однако, как и в случае эндофтальмита, частота этого осложнения невелика и равна 0,08–0,01 % [30].
Терапевтические агенты, которые вводятся внутрь глаза при помощи интравитреальной инъекции, могут обладать собственными побочными эффектами, однако их отсутствие или наличие не связано непосредственно с методикой.
В настоящее время не выявлено абсолютных противопоказаний для проведения интравитреальных инъекций [5]. Однако, например, считается, что наличие блефарита может повышать риск развития эндофтальмита [30]. В консенсусных рекомендациях 2018 года также считается, что если есть возможность безопасно провести инъекцию через pars plana по окружности в 360 °, то ее можно выполнить [5]. Это в том числе касается пациентов, у которых была операция по поводу глаукомы (например, с установкой шунта). В этом случае следует менять место инъекции таким образом, чтобы не было пересечения с местом предшествующего вмешательства.
Интравитреальные инъекции — это безопасный и крайне эффективный способ доставки лекарственных веществ непосредственно к тканям глаза. Шансы развития самого грозного осложнения — эндофтальмита — чрезвычайно низки при должном соблюдении всех рекомендаций. Высокая эффективность лечения (как в случае инъекции анти-VEGF-препаратов) перевешивает все гипотетические риски, поскольку здесь идет речь о сохранении зрения у пациентов. Косвенным свидетельством безопасности интравитреальных инъекций служит их чрезвычайно широкое распространение, которое не было бы возможным, не будь эта методика безопасной, хоть и требующей осторожности и тщательного соблюдения всех рекомендаций по проведению.
Оригинал: https://medach.pro/post/2879

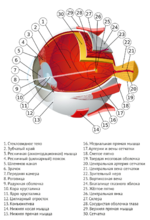
Рисунок 1 | Строение глазного яблока
Но эти же барьеры, защищающие внутренние структуры глаза от токсинов, бактерий и даже собственной иммунной системы, создают проблемы в случае развития различных заболеваний глаза. Как быть, если терапевтический агент не проходит сквозь гематоретинальный барьер или концентрация, необходимая для эффективного воздействия на структуры глаза, становится токсичной для остального организма?
История интравитреальных инъекций
Первые опыты введения каких-либо субстанций внутрь глаза начались еще в девятнадцатом – начале двадцатого века. Изначально этот метод был направлен на лечение отслойки сетчатки и внутриглазных кровоизлияний. Таким образом в те годы немецкий врач Дойчманн вводил в глаз экстракт стекловидного тела кролика [2], а его коллега Ом при помощи вводимого в глаз воздуха пытался вернуть на место отслоившуюся сетчатку [3].
Рисунок 2 | Заголовок одной из первых в мире статей, посвященных интравитреальным инъекциям
В последующие десятилетия исследователи ограничивались введением в глаз воздуха или физраствора. В 1940-х годах были опыты введения пенициллина для лечения эндофтальмита (гнойного воспаления глазного яблока), но те же авторы позже предпочли использовать системное и субконъюнктивальное введение препарата вместо инъекций в глаз. Интерес к методике возрос в 1960-е с открытием газовых смесей, которые могли длительное время оставаться внутри глаза, с целью лечения отслойки сетчатки. Новый скачок начался в 1970-е с изучением физиологии гематоретинального барьера. Понимание механизмов работы этого барьера позволило начать использовать антибиотики для лечения эндофтальмита (уже намного более осознанно, чем в 1940-е) и стероидные препараты для лечения воспалительных заболеваний в обход существующих анатомических барьеров. Вскоре в арсенал офтальмологов был добавлен целый спектр препаратов вплоть до противовирусных и противоопухолевых, которые стало возможным вводить внутрь глаза [4].
Настоящей революцией явилось открытие моноклональных антител, направленных против фактора роста эндотелия сосудов (VEGF) в 2000-е годы [4]. Этот совершенно новый тип препаратов оказалось возможным вводить внутрь глаза, чтобы в дальнейшем останавливать рост новообразованных сосудов при диабетической ретинопатии, влажной форме возрастной макулярной дегенерации, тромбозах центральной вены сетчатки, субретинальной неоваскулярной мембране и других патологиях. Это привело к взрывному росту применения данной методики, и уже в 2006 году в системе Medicare только в США было зарегистрировано 325 000 инъекций [4], тогда как с 1997 по 2001 годы по всему миру делалось не более 5000 инъекций в год [5]. В 2007 в США было сделано уже 800 000 инъекций, а в 2016 — 5,9 миллионов [5]. Такой взрывной рост был обусловлен высокой эффективностью данного способа лечения очень распространенных возрастной макулярной дегенерации и диабетической ретинопатии, а также относительной безопасностью самой методики. Это был буквально сдвиг парадигмы в лечении, что не так часто наблюдается в медицине.
Методика
Подготовка к инъекции
В своей серии заметок «Ophthalmic Pearls» Американская академия офтальмологии дает следующие рекомендации по подготовке к проведению интравитреальных инъекций [6]:
- нанесите топический анестетик (в виде капель) на поверхность глаза;
- нанесите несколько капель 5–10 %-ного раствора повидон-йода на поверхность глаза, дополнительно рекомендуется обработать повидон-йодом веки;
- установите стерильный векорасширитель;
- повторно выполните нанесение повидон-йода в область инъекции.
Техника выполнения и связь с анатомией
Инъекция осуществляется через pars plana цилиарного тела внутрь полости стекловидного тела. Для этого необходимо отступить на 3–3,5 мм кзади от лимба в случае афакичного (хрусталик отсутствует) или псевдофакичного (установлен искусственный хрусталик) глаза либо на 3,5–4 мм кзади от лимба в случае факичного глаза (присутствует нативный хрусталик). Эта зона достаточно безопасна для инъекции как с точки зрения низкого риска кровоизлияния, так и с точки зрения возможной травмы сетчатки. Категорически недопустимо проведение инъекции в области pars plicata цилиарного тела, поскольку там находится большое количество кровеносных сосудов, что незамедлительно приведет к кровоизлиянию. Инъекция, как правило, осуществляется в нижневисочном квадранте, хотя может быть использована и другая зона. Выбор именно такого расположения связан с минимизацией влияния на зрительную ось. Пациент при этом должен смотреть в сторону, противоположную месту инъекции, в течение всей манипуляции [4–6, 8].

Рисунок 3 | Трехмерная модель переднего отрезка глазного яблока, сделанная на основе данных рентгеновской микротомографии. По материалам [7].
Иглу необходимо направить в сторону средней части стекловидного тела скосом кверху, а вводить вещество необходимо крайне медленно, чтобы избежать формирования струи или кавитационного потока. Иглу не следует вводить в область инъекции до конца, что связано с уменьшением риска травматизации структур глаза, особенно в случае движения глазных яблок. После введения раствора в склеру иглу поворачивают к центру глазного яблока и осторожно вводят раствор в полость среднего стекловидного тела одним плавным непрерывным движением. Затем иглу извлекают, а место инъекции сразу же закрывают стерильным ватным тампоном, чтобы предотвратить рефлюкс [4].
Важные аспекты
Где выполнять инъекцию?
Вот уже много лет активно ведутся дискуссии, где проводить подобную инъекцию — в операционной либо в кабинете офтальмолога (in office), в первую очередь из-за опасений развития бактериального эндофтальмита как самого грозного осложнения инъекции [8]. С одной стороны, логично предположить, что в условиях операционной риски меньше из-за стерильности. С другой, при должном соблюдении правил асептики и антисептики риски эндофтальмита в случае выполнения процедуры in office примерно так же низки, как и в условиях операционной. Мало того, результат большого мета-анализа, опубликованный в журнале «JAMA Ophthalmology», показал, что значимой разницы в плане риска развития осложнений между выполнением инъекции в условиях операционной и в кабинете врача нет [9]. При условии соблюдения всех мер асептики и антисептики, разумеется. Тем не менее, стоит понимать, что в операционной изначально более строгий контроль чистоты, нежели в кабинете врача.
Анестезия
К задачам анестезии при интравитреальной инъекции относят [8]:
- предотвращение движений глаз пациента и непроизвольного закрытия век во время введения иглы;
- обеспечение комфорта пациента и повышение доверия к процедуре, которую, скорее всего, придется повторять несколько раз.
Асептика и антисептика
Контаминация области интравитреальной инъекции микрооорганизмами происходит из-за распространения резидентных бактерий, обитающих на веках пациента либо на слизистой полости рта (причем на слизистой рта не только пациента, но и лечащего врача, который разговаривает с пациентом) [5]. Последний факт был подтвержден многочисленными исследованиями, в том числе теми, где испытуемые зачитывали текст перед культуральными средами в чашках Петри, имитирующих пациента, находящегося в различных положениях [11]. По этой причине рекомендуется закрывать операционное поле стерильной клеенкой с вырезом под глаза, а врачу носить хирургическую маску. Это в дополнение к применению антисептиков значительно снижает риск эндофтальмита [12]. Тем не менее, использование клеенки для пациента, судя по всему, является опциональным [5, 13]. В том числе это связано с тем, что многие пациенты отмечают сильный дискомфорт и даже страх при закрытии их лица клеенкой [13]. Кроме того, рекомендуется меньше говорить в операционной или в кабинете в процессе подготовки и выполнения инъекции, особенно в том случае, если персоналом не используются маски [5, 13]. Вопрос пользы или даже вреда от ношения пациентами масок оказался настолько противоречивым, что будет разобран далее отдельно. Что касается стерильных перчаток, то в настоящее время не была доказана связь между их ношением и снижением рисков эндофтальмита [5, 13]. Очевидной (но важной) рекомендацией является тщательное мытье рук согласно всем правилам асептики и антисептики перед выполнением процедуры вне зависимости от того, используются ли стерильные перчатки [13].
В настоящий момент наиболее распространенным антисептиком для предоперационной подготовки окружающих мягких тканей и поверхности глаза является повидон-йод. Такое распространение связано с тем, что он обладает широким спектром микробицидной активности (уничтожает как бактерии и вирусы, так и споры грибков), а также не было отмечено случаев резистентности. Помимо этого, не было отмечено случаев анафилаксии и какого-либо повреждения тканей глаза. Нанесение 5 %-ного раствора повидон-йода на 30 секунд считается достаточным для микробицидного действия. В редких случаях наблюдается индивидуальная непереносимость повидон-йода либо каких-либо компонентов раствора, которая проявляется раздражением поверхностных структур глаза. Альтернативой повидон-йоду в этом случае является водный (!) раствор хлоргексидина биглюконата. Использование спиртового раствора категорически недопустимо из-за токсического действия на роговицу и другие ткани глаза [5].
Применение же антибиотиков для предоперационной подготовки, судя по всему, не только бесполезно, но и вредно. Во-первых, оно никак не снижает риск развития эндофтальмита, согласно проведенным исследованиям, а во-вторых, ведет к формированию резистентных штаммов микроорганизмов [5].
Калибр иглы
Выбор правильного диаметра и длины иглы важен не только для комфорта пациента, но и для безопасной процедуры инъекции и эффективности лечения. Наиболее часто используемые калибры игл варьируются от 27-го до 30-го калибра. Помимо этого, часто также используют иглы вплоть до 33-го калибра [5]. В настоящее время не существует единого мнения об идеальном калибре игл для интравитреальных инъекций. Тем не менее, лабораторные данные показывают, что использование игл 30-го калибра может уменьшить рефлюкс и ущемление стекловидного тела [14]. Если говорить о длине иглы, то согласно рекомендациям, она составляет от 14 до 18 мм [5].
Расширение зрачка
В настоящий момент нет единого мнения о необходимости расширения зрачка перед выполнением интравитреальной инъекции, однако это может быть полезным для начинающих врачей, так как позволяет незамедлительно оценить перфузию сосудов сетчатки сразу после интравитреальной инъекции [5].
Инъекция в оба глаза
Нередко бывает так, что пациенту требуется инъекция препарата в оба глаза, но возмозможность выполнения билатеральной инъекции в один день остается дискуссионной [5]. Исследование по типу случай-контроль с вовлечением пациентов, нуждающихся в двустороннем введении анти-VEGF препаратов, показало, что большинство пациентов предпочитали двусторонние инъекции, выполняемые в один и тот же день [15]. Другим аспектом, помимо удобства для пациентов, является экономическая эффективность для лечебного учреждения [16]. Тем не менее, рекомендуется взвесить все риски, чтобы избежать потенциальных осложнений, таких как двусторонний эндофтальмит. Согласно данным текущей литературы, двусторонняя интравитреальная инъекция, выполняемая в один и тот же день, кажется обычной процедурой. Рекомендуется обрабатывать каждый глаз последовательно, используя новую пару перчаток и отдельные стерильные инструменты, такие как векорасширители [5].
Положение иглы
Существует три основных положения иглы при выполнении интравитреальной инъекции: перпендикулярный (прямой), косой и двухплоскостной (туннельный) (рис. 4). В относительно недавнем проспективном исследовании сравнивалось влияние способа на кратковременные изменения внутриглазного давления (ВГД), рефлюкс стекловидного тела и другие осложнения [17]. Было выявлено, что двухплоскостной способ не отличается от других в плане осложнений. Более того, в других исследованиях было определено, что рефлюкс стекловидного тела был существенно ниже именно в случае двухплоскостного способа введения [18, 19].

Рисунок 4 | Схематическое изображение трех различных техник проникновения иглы
(А) перпендикулярно или прямо, (В) косо, (С) в двух плоскостях с созданием туннеля.
В последнем способе перфорируют склеру под углом 15–30 °, а затем иглу перемещают на 45–60 °. При этом игла все еще находится внутри склеры. Такой маневр создает туннель в двух отдельных плоскостях. После этого вводят препарат, а затем извлекают иглу под углом 90 °.
Схема взята из [8].
Расширение век
После нанесения повидон-йода или другого антисептика необходимо не допустить контакта век и ресниц с местом инъекции или шприцом. Лучшим способом для этого является установка стерильного векорасширителя, однако допускается использовать и другие методы, в том числе мануальное расширение век [5, 13].
Внутриглазное давление
Интравитреальное введение лекарственных средств может приводить к временному повышению ВГД (в англоязычной литературе используют термин IOP-spike для этого явления). Как правило, в клинической практике лекарственные средства вводят в объеме от 0,025 до 0,1 мл. Хотя этот объем равен всего лишь 1–2 % от объема стекловидного тела, это приводит как к кратковременному (в большинстве случаев), так и к долговременному повышению ВГД [5].
Однако повышение внутриглазного давления обусловлено не только объемом введенного лекарства, но и его свойствами [5]. Среди препаратов, которые могут провоцировать повышение ВГД, стоит отметить стероиды. Частота этого явления, как сообщается, составляет от 30 до 60 % после интравитреального введения триамцинолона ацетонида [20] и от 30 до 50 % — после использования дексаметазоновых имплантатов (Ozurdex®) [21]. Анти-VEGF препараты также могут вызывать повышение ВГД в 12 % случаев [5]. Было предложено несколько механизмов этого побочного эффекта, включая токсические изменения, транзиторное воспаление с продукцией цитокинов, которые способствуют повышению ВГД, и механическую блокаду трабекулярной сети [22, 23].
В большинстве случаев повышение ВГД либо преходящее, либо его легко контролировать с помощью местного лечения [16–18]. Однако как краткосрочное, так и долгосрочное повышение ВГД нежелательно, особенно у пациентов, у которых имеется глаукома. Таким образом, при выполнении инъекции важно уточнить наличие офтальмогипертензии или глаукомы и тщательно контролировать ВГД у таких пациентов.
Снижение ВГД перед выполнением интравитреальной инъекции, как правило, не требуется, но может быть использовано у пациентов с прогрессирующей глаукоматозной нейропатией зрительного нерва и у тех, у кого высок риск длительного постинъекционного скачка ВГД, а также у тех, у кого любой скачок ВГД может привести к поражению чувствительных структур глаза, таких как зрительный нерв [13]. Помимо пальцевого массажа, для снижения ВГД могут быть использованы такие классические препараты для лечения глаукомы, как бримонидин или тимолол. Другим способом является создание парацентеза в роговице, чтобы выпустить немного водянистой влаги [5, 13]. Эти меры, выполненные до интравитреальной инъекции, статистически значимо снижают ВГД после самой инъекции [5].
Важно отметить, что любая степень предшествующей глазной гипертензии или глаукомы не является противопоказанием для интравитреальной инъекции. Поскольку конечной целью является сохранение зрения, эти патологические состояния необходимо лечить одновременно с заболеванием, которое потребовало интравитреального введения препарата [5].
Ношение пациентами масок
Вокруг того, нужно ли пациентам носить хирургические маски, в последние годы развернулась нешуточная дискуссия. Если раньше, до пандемии COVID-19, в статьях и рекомендациях склонялись к тому, что это может быть как минимум полезным в плане снижения распространения бактерий из полости рта пациента в область инъекции [5, 8, 13], то после того, как маски стали буквально вездесущими и обязательными в том числе для пациентов [24], стали появляться и противоположные этому суждения.
В нашумевшем исследовании, опубликованном в 2020 году, при помощи инфракрасной камеры отслеживали распределение потоков воздуха в зависимости от типа масок (маски на завязках, маски на резинках и респираторы типа N95). Было обнаружено, что использование масок в 91 % случаев приводит к изменению направления потоков воздуха в сторону глаз [25].
В дальнейшем норвежские исследователи опубликовали короткую заметку о том, что случаев эндофтальмита в стенах Университетской клиники Осло стало больше по сравнению с допандемийными временами, что авторы связали с обязательным ношением масок [26]. Тем не менее, пока эти данные не были подтверждены [27], в том числе в ходе многоцентровых исследований [28].
Тем не менее, можно задаться вопросом: если все носят маски, и они не приводят к более частому развитию эндофтальмита, может быть, ношение пациентом маски снижает риски развития данного осложнения, как было предположено ранее? Оказалось, что нет, — обязательное ношение масок не привело к тому, что случаев развития эндофтальмита стало меньше за последние два года [29]. Разумеется, это еще только предварительные данные, но, тем не менее, уже можно говорить о том, что целесообразность ношения масок пациентами является достаточно спорной.
Резюме
Подведем итоги в виде небольшой таблицы, где суммированы рекомендации относительно проведения интравитреальных инъекций.

Осложнения
Разумеется, как и у любого другого медицинского вмешательства (а интравитреальная инъекция, безусловно, является вмешательством, причем почти хирургическим), при интравитреальной инъекции могут быть осложнения. Самым грозным из них является эндофтальмит, однако шанс его развития находится буквально на уровне статистической погрешности и составляет 0,032 % (3,2 случая на 10 000 инъекций) [29]. Такая низкая частота встречаемости связана с тем, что это очень грозное осложнение легко предотвратить при должном соблюдении всех мер асептики и антисептики. Другим осложнением, связанным непосредственно с методикой, является разрыв или отслойка сетчатки. Однако, как и в случае эндофтальмита, частота этого осложнения невелика и равна 0,08–0,01 % [30].
Терапевтические агенты, которые вводятся внутрь глаза при помощи интравитреальной инъекции, могут обладать собственными побочными эффектами, однако их отсутствие или наличие не связано непосредственно с методикой.
Противопоказания
В настоящее время не выявлено абсолютных противопоказаний для проведения интравитреальных инъекций [5]. Однако, например, считается, что наличие блефарита может повышать риск развития эндофтальмита [30]. В консенсусных рекомендациях 2018 года также считается, что если есть возможность безопасно провести инъекцию через pars plana по окружности в 360 °, то ее можно выполнить [5]. Это в том числе касается пациентов, у которых была операция по поводу глаукомы (например, с установкой шунта). В этом случае следует менять место инъекции таким образом, чтобы не было пересечения с местом предшествующего вмешательства.
Выводы
Интравитреальные инъекции — это безопасный и крайне эффективный способ доставки лекарственных веществ непосредственно к тканям глаза. Шансы развития самого грозного осложнения — эндофтальмита — чрезвычайно низки при должном соблюдении всех рекомендаций. Высокая эффективность лечения (как в случае инъекции анти-VEGF-препаратов) перевешивает все гипотетические риски, поскольку здесь идет речь о сохранении зрения у пациентов. Косвенным свидетельством безопасности интравитреальных инъекций служит их чрезвычайно широкое распространение, которое не было бы возможным, не будь эта методика безопасной, хоть и требующей осторожности и тщательного соблюдения всех рекомендаций по проведению.
Оригинал: https://medach.pro/post/2879
Источники:
- Cholkar K. et al. Eye: anatomy, physiology and barriers to drug delivery //Ocular transporters and receptors. – Woodhead publishing, 2013.
- Peyman G. A., Ericson E. S., May D. R. A review of substances and techniques of vitreous replacement //Survey of ophthalmology. – 1972.
- Ohm J. Über die Behandlung der Netzhautablösung durch operative Entleerung der subretinalen Flüssigkeit und Einspritzung von Luft in den Glaskörper //Albrecht von Graefes Archiv für Ophthalmologie. – 1911.
- Peyman G. A., Lad E. M., Moshfeghi D. M. Intravitreal injection of therapeutic agents //Retina. – 2009.
- Grzybowski A. et al. 2018 update on intravitreal injections: Euretina expert consensus recommendations //Ophthalmologica. – 2018.
- Michelle E. Wilson, Adrienne W. Scott,How to Give Intravitreal Injections. American Academy of opthalmology. Доступно по адресу: https://www.aao.org/eyenet/art...
- Tkachev S. Y. et al. Visualization of different anatomical parts of the enucleated human eye using X-ray micro-CT imaging //Experimental Eye Research. – 2021.
- Myers (Provencher) LA, Almeida D, Abràmoff MD. Intravitreal Injection Technique: A Primer for Ophthalmology Residents and Fellows. EyeRounds.org. Доступно по адресу: http://www.EyeRounds.org/tutor....
- Li T. et al. Safety of Receiving Anti–Vascular Endothelial Growth Factor Intravitreal Injection in Office-Based vs Operating Room Settings: A Meta-analysis //JAMA ophthalmology. – 2021.
- Kaderli B., Avci R. Comparison of topical and subconjunctival anesthesia in intravitreal injection administrations //European journal of ophthalmology. – 2006.
- Wen J. C. et al. Bacterial dispersal associated with speech in the setting of intravitreous injections //Archives of ophthalmology. – 2011.
- Shimada H. et al. Minimizing the endophthalmitis rate following intravitreal injections using 0.25% povidone–iodine irrigation and surgical mask //Graefe's Archive for Clinical and Experimental Ophthalmology. – 2013.
- Avery R. L. et al. Intravitreal injection technique and monitoring: updated guidelines of an expert panel //Retina. – 2014.
- De Stefano V. S. et al. Experimental investigation of needles, syringes and techniques for intravitreal injections //Clinical & Experimental Ophthalmology. – 2011.
- Fagan X. J., Al‐Qureshi S. Intravitreal injections: a review of the evidence for best practice //Clinical & experimental ophthalmology. – 2013.
- Rayess N. et al. Postinjection endophthalmitis rates and characteristics following intravitreal bevacizumab, ranibizumab, and aflibercept //American journal of ophthalmology. – 2016.
- Özkaya A. et al. Comparing the effects of three different intravitreal injection techniques on vitreous reflux and intraocular pressure //Journal of ocular pharmacology and therapeutics. – 2013.
- Rodrigues E. B. et al. Tunneled scleral incision to prevent vitreal reflux after intravitreal injection //American journal of ophthalmology. – 2007.
- Rodrigues E. B. et al. Effect of needle type and injection technique on pain level and vitreal reflux in intravitreal injection //Journal of Ocular Pharmacology and Therapeutics. – 2011.
- Yuksel-Elgin C., Elgin C. Intraocular pressure elevation after intravitreal triamcinolone acetonide injection: a Meta-analysis //International Journal of Ophthalmology. – 2016.
- Mazzarella S. et al. Effect of intravitreal injection of dexamethasone 0.7 mg (Ozurdex®) on intraocular pressure in patients with macular edema //Ophthalmic Research. – 2015.
- Dedania V. S., Bakri S. J. Sustained elevation of intraocular pressure after intravitreal anti-VEGF agents: what is the evidence? //Retina. – 2015.
- SooHoo J. R., Seibold L. K., Kahook M. Y. The link between intravitreal antivascular endothelial growth factor injections and glaucoma //Current Opinion in Ophthalmology. – 2014.
- Shmueli O., Chowers I., Levy J. Current safety preferences for intravitreal injection during COVID-19 pandemic //Eye. – 2020.
- Hadayer A. et al. Patients wearing face masks during intravitreal injections may be at a higher risk of endophthalmitis //Retina. – 2020.
- Blom K. et al. Mask use by patients in the context of COVID‐19 can increase the risk of postinjection endophthalmitis //Acta Ophthalmologica. – 2021.
- Bisorca‐Gassendorf L. et al. Patients face masks do not increase the risk of post‐injection endophthalmitis //Acta Ophthalmologica. – 2021.
- Patel S. N. et al. The influence of universal face mask use on endophthalmitis risk after intravitreal anti–vascular endothelial growth factor injections //Ophthalmology. – 2021.
- Karimi S. et al. Incidence and management of acute endophthalmitis after intravitreal injection of bevacizumab //International Ophthalmology. – 2022.
- Sampat K. M., Garg S. J. Complications of intravitreal injections //Current opinion in ophthalmology. – 2010.
- Lyall D. A. M. et al. Post-intravitreal anti-VEGF endophthalmitis in the United Kingdom: incidence, features, risk factors, and outcomes //Eye. – 2012.

