Первичные и/или побочные симптомы низких и высоких уровней эстрогенов, объяснение и практическая схема принятия решений для симптомов низких уровней эстрогенов в результате использования Примы и/или EQ.
- Введение.
Что происходит здесь – как разные люди могут испытывать такие заметно разные, даже противоположные эффекты от тех же самых лекарств при похожих дозах ?
- Цели.
- Ответить на этот вопрос строгим образом, чтобы раскрыть то, что не было сразу очевидно, и, надеемся, узнать какие-то ценные факты в результате.
- Предложить решения для тех, кто испытывает неприемлемые симптомы низкой эстрогенности в результате немедицинского использования ААС.
- Тезис.
Эффекты каждого анаболического-андрогенного стероида (ААС) на эстрогенность (эффекты, связанные с активацией ER-α и β) зависят от Факторов, Зависимых от Соединения (Персонально для каждого ААС) и Индивидуализированных (Персонально для каждого пользователя) факторов, которые определяют как А. фактические уровни в крови, так и Б. эффекты на уровне тканей каждого ароматизируемого продукта ААС.
Ароматизируемые продукты, производимые ААС, варьируются от нуля (т.е., неароматизируемые), до E1 (эстрон), слабого эстрогена, до E2 (эстрадиол), мощного (самого мощного эндогенного) эстрогена, о существовании которого знают почти все читатели и который ассоциируется с классическими эстрогенными эффектами (будь E2 "снижен" или иначе), до неэндогенных и высокоактивных эстрогенов, таких как 7α-метилэстрадиол (чрезвычайно мощный ароматизируемый продукт MENT).
Эффекты каждого ААС (при его дозировке и продолжительности) и его ароматизируемых продуктов (при их концентрациях и продолжительности) определяют соотношение андроген:эстроген (А/Е), косвенный показатель общих системных эффектов ААС (прямых и побочных) (например, гинекомастия). "Андрогенное звено" соотношения А/Е является продуктом способности ААС активировать AR в его площади под кривой (AUC) как nmol×h/L. "Эстрогенное звено" соотношения А/Е имеет две составляющие: эстрогенные против антиэстрогенных эффектов. Что касается эстрогенных эффектов, они являются продуктом концентрации и продолжительности (AUC как nmol×h/L) ароматизируемых продуктов (т.е. эстрогенов) и их способности активировать ER-α и β. Взаимно, антиэстрогенные эффекты, которые являются врожденными классовыми эффектами ААС, хорошо установленными у людей и животных, возникают из-за эффектов ААС на гипофиз (т.е. антигонадотропные) и местные тканевые эффекты (например, предотвращение усвоения эстрогенов), возвращаясь к "андрогенному звену".
Индивидуализированные (персональные для каждого пользователя) эффекты ААС на эстрогенность в значительной степени зависят от трех (3) отдельных наследственных факторов (т.е. результат генетического фенотипа), которые подвержены широкой межиндивидуальной вариабельности (различия между пользователями) - профиль связывающих гормонов¹, экспрессия изофермента 17β-HSD² и экспрессия Ароматазы³. Во-первых, профиль связывающих гормонов пользователя¹ (т.е. SHBG, альбумин, альфа₁-кислый гликопротеин, глобулин, связывающий кортикостероиды) определяет активность свободных E1/E2 (свободных эстрогенов) и соотношение свободных E1/E2:андроген. Во-вторых, этот профиль связывающих гормонов¹ взаимодействует с скоростью ароматизации ААС (Vmax) и длиной эфирной цепи (т.е. logP и гидрофобностью), по мере увеличения концентрации лекарства до установившегося состояния, влияя на градиент концентрации активных эстрогенов (свободных E1 и E2), поскольку эстераза освобождает родительский гормон от производного лекарства за счет активного гидролиза в полной крови [4]. В-третьих, экспрессия изофермента 17β-HSD пользователя² определяет чистый поток E1 (слабого эстрогена) против E2 (мощного эстрогена). Наконец, экспрессия Ароматазы пользователя³ – частично модифицируемая саморегулируемой массой жировой ткани – определяет абсолютные концентрации эстрогенов (E1 и E2).
Примечание: Пока не отчаивайтесь из-за этого подавляющего изложения Факторов, Влияющих на Концентрации Эстрогенов в Крови и Эстрогенную Активность на Уровне Тканей, поскольку мы еще не разобрали их. Продолжайте читать – автор разберет эти факторы по ходу дела.
- Иллюстрация опасностей, связанных с выводами или заключений на основе лабораторных анализов крови от различных пользователей интернета; различие в эстрогенном эффекте EQ и Примы; и ограничения циркулирующих уровней как индекса тканеспецифической регуляции эстрогенов.
Из реальных отчетов пользователей интернета, которые сообщали об использовании EQ и/или Примы –
Четыре (4) отдельных случая, когда ингибитор ароматазы (AI) не использовался:
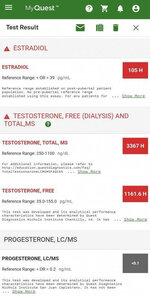
1. Повышение уровня E2 и E1 в сыворотке на фоне приема 800 мг EQ, 600 мг Трен, 300 мг Тест:
EQ (800 мг) + Трен (600 мг) + Тест (300 мг) Анализы крови на Эстрон (E1): 1,352 пмоль/л (Референсный диапазон: < 250 пмоль/л), т.е., 365.6 пг/мл (Очень Высоко)
2. Повышение уровня E2 в сыворотке при приеме 300 мг Примы, 300 мг Тест:
* Примо + Тест анализы крови на E2 низкие-умеренные
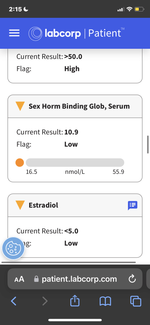
3. Снижение до субнормального уровня E2 при приеме 750 мг Тест, 500 мг EQ, 400 мг Примы:
* Анализы крови на E2 при приеме Тест + EQ + Примо
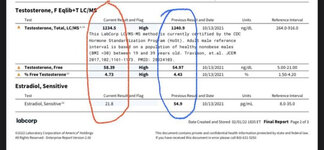
4. Поддержание нормального уровня E2 при приеме 300 мг Тест, 180 мг Примы:
* Примы 180 мг + Тест Е 300 мг (красный) против Тест С 150 мг (синий)
К каким выводам должен прийти читатель, исходя из этих данных?
То, что делать любые выводы (не говоря уже о заключениях) из этих различающихся результатов - это глупость. Они указывают нам только на один факт – лишь на то, что EQ и/или Примаболан в некоторых случаях, кажется, снижают эстрогенность, отражаемую анализами крови.
Скорее чем внушать уверенность, эти результаты вдохновляют на противоположное – неопределенность. Эти результаты анализов крови иллюстрируют опасности, связанные с выводами или заключениями на основе лабораторных анализов крови от различных пользователей интернета.
После того как читатель поймет Ограничения Циркулирующих Уровней как Индекса Тканеспецифической Регуляции Эстрогенов, автор объяснит – настолько кратко, насколько позволяют доказательства и вопрос – Факторы, Влияющие на Концентрации Эстрогенов в Крови и Тканеспецифическую Эстрогенную Активность, чтобы «заглянуть под капот» и понять, что может быть причиной этого различия в эстрогенных эффектах EQ и Примо.
- Ограничения Циркулирующих Уровней как Индекса Тканеспецифической Регуляции Эстрогенов.
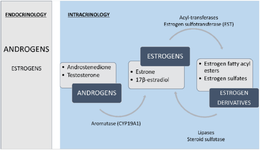
Регуляция производства и метаболизма эстрогенов в периферических тканях обеспечивается за счет локальной экспрессии Ароматазы (CYP19A1), которая превращает андрогены в эстрогены (T ⇒ E2 и AD ⇒ E1 [E2 является наиболее распространенным эстрогеном у мужчин; что может объяснять большую терпимость к EQ у женщин]). Эстрогены далее могут превращаться в сульфаты эстрогенов и жирно-ацильные эфиры эстрогенов через Эстроген-Сульфотрансферазу (EST) и Ацил-Трансферазы соответственно. Наконец, эти производные эстрогенов могут быть превращены обратно в родительские эстрогены за счет действия Стероидной Сульфатазы (Сульфатазы) и Липазы [10].
Жировая ткань (AT) особенно обогащена жирно-ацильными эфирами эстрогенов и, следовательно, имеет обширную систему буферизации, которая позволяет локально регулировать производство и метаболизм эстрогенов… В частности, в исследовании с участием ожиревших мужчин было показано, что концентрации жирно-ацильных эфиров E2 коррелируют в сыворотке и жировой ткани (Wang и др., 2013) [10], что, возможно, указывает на то, что уровни эстрогенов в сыворотке влияют на содержание накопленного эстрогена в AT, но превращение в биоактивные формы регулируется локально [10].
Несколько клинических исследований показали диссоциации между циркулирующими и внутрижировыми уровнями эстрогенов, включая исследования с участием мужчин (Blankenstein и др., 1992; Belanger и др., 2006; Deslypere и др., 1985; Wang и др., 2013) [10].
- Осложняющие Факторы в Самостоятельной Отчетности об Эстрогенности от EQ и/или Примы.
- Анализы лабораторных показателей крови могут не отражать эстрогенность, поскольку вовлечены механизмы на уровне тканей (например, блокада усвоения эстрогена, внутренняя против эндокринная активность).
- Межиндивидуальные различия в профиле связывающих гормонов¹, экспрессии изофермента 17β-HSD² и экспрессии Ароматазы³, не говоря уже о таких факторах, как экспрессия ER (т.е., плотность или количество) в, например, ткани груди (факторы, участвующие в переносимости).
- Неполнота лабораторных анализов крови при использовании EQ (т.е. измерения уровня E2 в сыворотке недостаточны без измерений E1).
- Подделка или замена продукта (например, Прима заменяется Тестом).
- Различия в длине эфира (например, Bold Cyp против EQ), отражающие logP: коэффициент разделения и липофильность: полярность; глубина инъекции (например, в подкожное пространство против глубокой внутримышечной) и место введения, которые отличаются по кровотоку и, следовательно, активности Эстеразы, косвенно влияя на скорость реакций Ароматазы.
- Предполагаемые самостоятельные отчеты от профессионалов фитнеса, получающих доход от создания новостных материалов, могут быть мотивированы искажением и/или мошенничеством с целью увеличения дохода от рекламы как минимум, если не для интеграции их захватывающих и новых находок в их портфолио – или "любимые концепции" – чтобы использовать их как знак отличия, на основе которого их работа (например, видео на YouTube, публикации) будет идентифицирована и выделена.
- Факторы, Влияющие на Концентрации Эстрогенов в Крови и Тканеспецифическую Эстрогенную Активность.
1. Ароматизируемые продукты и их способность активировать ER-α и β (в предстоящей статье будет рассмотрена роль, которую эстрогены играют у мужчин, для отдельных биологических функций этих рецепторов).
a) EQ =[Ароматаза]=> E1 (эстрон, слабый эстроген, потенция ER-α 2% по сравнению с E2) и E2 (эстрадиол, 17β-OH делает его в 50 раз более мощным, чем E2) {ароматизируется в E1 и E2}.
b) Прима =X[Ароматаза] {не ароматизируется}, следовательно, не преодолевает:
2. Антиэстрогенные эффекты, которые являются классовыми эффектами ААС:
a) Ингибирование гонадотропинов, секретируемых гипофизом (которые косвенно снижают эстрогены), и
b) Прямая блокада активности эстрогена на уровне целевого органа, предотвращая усвоение эстрогена, например, в синовиальные клетки, вызывая симптомы "сухих, болезненных суставов". Именно этот эффект делает Приму [1], [2] – и до его прекращения из-за непереносимых андрогенных побочных эффектов – Мастерон [3], таким эффективным для лечения резистентного к лечению метастатического рака груди.
3. EQ: a) сниженная скорость ароматизации (Vmax) по отношению к болденону (родительскому гормону EQ).
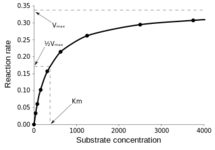
Km: равно концентрации субстрата (абсцисса; значения по оси x), когда скорость составляет половину максимальной скорости (1/2Vmax; ордината; значения по оси y).
T: тестостерон
Ароматизация затруднена (по сравнению с T) для андроста-1,4-диен-3-онов (как болденон; EQ; BU), так что процесс протекает медленно [17].
T =[Ароматаза]=> E2, Κm = 1.83нМ, согласно кинетике Михаэлиса-Ментен [18].
Мы не знаем Km для in vivo активности Ароматазы по отношению к EQ (болденон ундециленат; BU). Однако мы знаем, что фермент Ароматаза насыщается, так что выше некоторой дозы, которая зависит от экспрессии Ароматазы³ или количества белка (и профиля связывающих гормонов¹), дополнительное увеличение не вызовет дальнейшего повышения активных эстрогенов (свободных E2 и E1). Поскольку EQ (болденон ундециленат; BU) подвергается затрудненной ароматизации, его скорость реакции (Vmax) должна быть относительно замедлена. Таким образом, его in vivo Km должен быть смещен вправо (по сравнению с T/E2), требуя более высоких концентраций, чем T для насыщения Ароматазы. Это говорит нам о том, что по сравнению с T, перед насыщением Ароматазы необходимы более высокие дозы болденона (не подверженные дальнейшему повышению E2 при дозах выше точки насыщения).
Из [18] мы также знаем, что на 40% более высокая Vmax Ароматазы по сравнению с T у пожилых по сравнению с молодыми мужчинами была практически полностью объяснена массой жировой ткани и SHBG (т.е. профилем связывающих гормонов¹). Поскольку Ароматаза экспрессируется в адипоцитах (жировых клетках), которые подвергаются увеличению числа за счет липогенеза новых жировых клеток (адипоцитов), поддержание низкого процента жировой ткани на протяжении всей жизни является важным фактором, находящимся под контролем читателя. Понимайте, что жировые клетки не уничтожаются ограничением калорий – визуальный вид низкого содержания жировой ткани после диеты не отражает потерь числа адипоцитов, а лишь уменьшенные запасы липидов в этих клетках. Только лизинг или замораживание (например, химический лизинг, как Kybella; CoolSculpting и т.д.) для последующего удаления через фекалии или липосакция (физическое удаление) жировых клеток фактически уничтожает жировые клетки, так что уменьшение ароматизации произойдет.
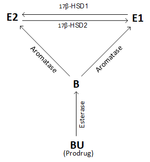
Рисунок: интерконверсия E2 и E1 с помощью 17β-HSD после внутримышечного введения болденона ундецилената (BU; EQ).
Индивидуализированные (Персональные для каждого пользователя) Факторы:
4. В зависимости от профиля связывающих гормонов конкретного индивидуума¹, более медленное высвобождение из депо для EQ до достижения устойчивого состояния почти наверняка приведет к снижению активности Ароматазы.
5. В зависимости от экспрессии изофермента 17β-HSD конкретного индивидуума², чистый поток эстрогенов может привести к тому, что E1 > E2 после приема EQ, что приведет к преобладанию в кровообращении гораздо более слабого эстрогена по сравнению с E2.
6. В зависимости от экспрессии Ароматазы конкретного индивидуума³, переносимость эстрогенности от ароматизируемого андрогена (например, EQ) частично зависит от количества Ароматазы.
Примечание: Таким образом, хотя есть некоторые данные (рисунок выше), что Прима (метенолон энантат; ME) имеет высокую вероятность связывания с Ароматазой (Цитохром P450 19A1) (вероятность 88%) – конкурентное ингибирование которой уменьшило бы уровень E2 в сыворотке – и низкие вероятности связывания с 17β-HSD1, 17β-HSD2 и 17β-HSD3 – данный автор не будет делать предположений о потенциальных механизмах воздействия на эстрогенность, потому что модель просто не нуждается в них. Кроме того, мы просто не знаем, какой режим связывания он бы использовал, ни его биологическую значимость. Это исключительная область "бро-науки" заниматься такими безудержными спекуляциями.
Индивидуализированные факторы для каждого пользователя (определения):
- ¹: профиль связывающих гормонов: деятельность SHBG, альбумина, α₁-кислого гликопротеина и глобулина, связывающего кортикостероиды, влияет на неактивные связанные против активных свободных частей андрогенов и эстрогенов.
- ²: экспрессия изофермента 17β-HSD: относительное количество изоферментов 17β-HSD типа 1 против типа 2 определяет относительные пропорции и абсолютные уровни циркулирующих E2 и E1 соответственно.
- ³: экспрессия Ароматазы: абсолютное количество белков Ароматазы определяет уровни продуктов ароматизации (т.е. эстрогенов).
- 17β-HSD.
Все ферменты 17β-HSD катализируют окисление или восстановление углерода в позиции 17 стероидного субстрата:
- различные предпочтения субстрата (например, E1, E2, T, 3β-диол, DHT)
- различные физиологические функции (Jansson, 2009) [15].
Чтобы не перегружать читателя слишком сложной информацией, данная работа сосредоточится на первых двух (2) основных изоформах 17β-HSD (тип 1, тип 2).
17β-HSD1 (тип 1), находящийся под контролем гена A1-Q327, катализирует восстановление стероидов (эстрогены, андрогены) с 17-кето в тот, у которого в той же позиции гидроксильная группа. Таким образом, из E1 (эстрон) =[17β-HSD1]=> E2 (эстрадиол) и из AD =[17β-HSD1]=> T.
Экспрессия 17β-HSD1 положительно коррелирует с активацией E1 и уровнями E2 [15], и её ингибирование приводит к снижению. Ингибирование 17β-HSD1 => ↓E2 [16].
17β-HSD2 (тип 2) обращает реакции 17β-HSD1 (т.е. E2 =[17β-HSD2]=> E1 и E3 =[17β-HSD2]=> 16α-гидроксиэстрон) и превращает T =[17β-HSD2]=> AD (андростендион), окисляя 17-гидроксильную группу и заменяя C-17 на 17-кетогруппу.
Относительное переизбыток экспрессии 17β-HSD2 и недостаток экспрессии 17β-HSD1 приводят к чистому эффекту увеличения эстрона (E1), подверженному межиндивидуальным различиям в метаболизме.
- Ароматаза.
Ароматаза — единственный фермент человека, способный к ароматизации стероидного А-кольца, тем самым превращая андрогены в эстрогены [21].
Этот фермент отщепляет 19-метиловую группу от ААС и перестраивает стероидное А-кольцо таким образом, что формируются три чередующихся двойные связи. Эта конфигурация А-кольца описывается как ароматическая (отсюда и происходит термин ароматизация).
У мужчин наблюдается вариабельность в росте и экспрессии гена Ароматазы [22]. Это имеет смысл, поскольку эстрогены, произведенные за счет ароматизации эндогенного Т в E2, имеют жизненно важное значение для роста и поддержания костей у мужчин.
- Симптомы низкой эстрогенности
2. Потеря костной массы – Эстрогены играют ключевую роль в предотвращении потери минерального содержания/плотности костей. Хотя андрогены оказывают значительное влияние на мужские кости, эстрогены важнее для роста и поддержания костей... E2 необходим для нормальной минерализации костей, массы и оборота костей, но не для линейного роста костей у мужчин (648, 649) [9].
3. Инсулиновая резистентность – Метаболизм глюкозы на килограмм мышечной массы у женщин на 45% выше (756) (вероятно, опосредовано ER-α) [9]. У мужчин, полезные метаболические эффекты тестостерона опосредованы его продуктом ароматизации (E2) больше, чем андрогеном (E2 > T в уменьшении жировых отложений)… около 15% циркулирующих эстрогенов происходит из синтеза и секреции в яичках (клетки Лейдига), остальное – за счет периферийной активности Ароматазы… [9].
4. Увеличение жировой ткани (↑AT; AT: адипозная ткань) – У мужчин, E2 регулирует запасы жировой ткани больше, чем T. ERKO: мутация рецептора эстрогена (нокаут по рецептору эстрогена) у самцов мышей привела к увеличению жировых депо на 100% в возрасте 9 – 12 месяцев… это отражает как гиперплазию, так и гипертрофию адипоцитов (281), сопровождаемую глюкозной непереносимостью и инсулиновой резистентностью (IR) [9]. Самцы мышей с нокаутом по ERα показали увеличение воспаления в AT, размера адипоцитов и ухудшенную толерантность к глюкозе [9].
5. Сексуальная дисфункция – Сигнализация через ER-α у мужчин поддерживает: функции эфферентных протоков и эпидидимиса; транспорт ионов и реабсорбцию воды, необходимые для поддержания нормальной спермы (мужская репродуктивная функция); мозг, жировую ткань, скелетные мышцы, кости, сердечно-сосудистую и иммунную ткани [9].
6. ?Снижение реактивности скелетных мышц на анаболические стимулы – На данный момент нет подтверждения этому в отношении симптомов низкой эстрогенности, вызванных ААС. Несмотря на распространенное среди культуристов мнение, что использование ИА (ингибиторы ароматазы) / СЕРМ (селективные модуляторы эстрогеновых рецепторов), действующих антиэстрогенно в скелетных мышцах, снижает анаболизм мышц; или что очень высокий уровень E2 способствует анаболизму мышц – эти утверждения не подтверждены реальными данными (т.е., не подвергнуты строгому планированию исследований и статистическим методам для различения причин, эффектов и случайных совпадений). То, что подтверждено, так это то, что гормональная терапия заместительной терапии эстрогенами (ГЗТ, в литературе; отличается от терапии заместительной терапии тестостероном) увеличивает синтез белка в мышцах (MPS), вызванный силовыми тренировками (RT), но за счет базального MPS (т.е., заместительная терапия эстрогенами у женщин после менопаузы снижает 24-часовой MPS) [10]… Хотя данные о жвачных животных (например, крупный рогатый скот) подтверждают использование экзогенного E2 + андрогена (например, ацетат тренболона), это, подобно ГЗТ (замена эстрогена) у женщин после менопаузы, не аналогично ААС у здоровых мужчин.
- Поскольку женщины после менопаузы старше и обычно не ищут ГЗТ (замена эстрогена) в течение нескольких лет после прекращения менструаций, простая связь между низкими эстрогенами и ослабленной реактивностью на анаболические стимулы, скорее всего, связана с другими возрастными факторами, а не с пониженными эстрогенами (например, сниженной регенеративной способностью спутниковых клеток и уменьшенной экспрессией мРНК IGF-IEc в скелетных мышцах).
- Поскольку жвачные животные не испытывают увеличения IGFBP-1 в ответ на экзогенный E2, как люди [11], что снижает доступность свободного IGF-I и (эндогенно) увеличивает секрецию ГР за счет обратной связи, любая связь между эстрогеном и анаболизмом в скелетных мышцах человека в лучшем случае ненадежна – и, вероятно, является всего лишь второстепенным фактором, связанным скорее с эндогенным T и процессом ароматизации (увеличивающим IGF-I), чем с продуктом ароматизации. Эстроген (например, E2) дозозависимо увеличивает IGFBP-1 – это причина, по которой у женщин гораздо выше уровни эндогенного ГР, но пропорционально ниже уровни IGF-I, чем у мужчин по площади поверхности тела (сниженный ответ ГР) [13], и почему те, кто принимает гормональные контрацептивы (т.е., эстрогены), должны увеличивать дозы rhGH, чтобы увидеть преимущества для роста и метаболизма, например, при дефиците гормона роста у взрослых [14]. У женщин в предменопаузе оральный этинилэстрадиол снижает уровни IGF-I на 30% в среднем (24 – 27) [13].
Использование Примы (метенолон энантат; ME) и/или EQ (болденон ундециленат; BU) может привести к симптомам низкой эстрогенности, которые могут (или не могут) отражаться в субнормальных концентрациях E2 в крови.
Применение Примы и/или EQ в соответствии с тезисом автора.
См. Теорию эстрогенных потенций (модель автора):
Каждый ААС влияет на чистый поток эстрогенности за счет его конкретных эффектов на концентрации эстрогенов в крови и тканеспецифическую эстрогенную активность следующим образом:
Примаболан:
Прима, как неароматизируемый ААС, не производит эстрогены. В результате при умеренных/высоких дозах его эффекты на чистый поток эстрогенности с точки зрения аспектов зависимых от соединения (персонально для каждого ААС) эффектов будут явно антиэстрогенными – ингибирование гонадотропинов, секретируемых гипофизом (которые косвенно снижают эстрогены у мужчин за счет подавления эндогенного синтеза и секреции Т [стероидогенез], от которого зависит биосинтез эстрадиола [E2] у мужчин), и прямая блокада активности эстрогена на уровне целевого органа, предотвращая поглощение эстрогена клетками (например, синовиальными клетками, вызывая симптомы "сухих, болезненных суставов").
EQ:
EQ ароматизируется с 58% скоростью тестостерона... в эстрон (E1) и эстрадиол (E2) [5]. E1 является слабым эстрогеном, потому что ему не хватает 17β-OH группы E2, обладая всего лишь 2% потенции E2 для трансактивации ER-α [6]. Поскольку экспрессия изофермента 17β-HSD конкретного индивидуума² определяет чистый поток баланса E1/E2, она особенно контролирует в случае эффектов EQ на чистый поток эстрогенности.
EQ подвержен большим межиндивидуальным различиям с точки зрения всех трех перечисленных факторов (профиль связывающих гормонов¹, экспрессия изофермента 17β-HSD² и экспрессия Ароматазы³). Его относительно медленная Vmax (скорость реакции Ароматазы), ароматизация в E1 (слабый эстроген) и E2, свободные против связанных долей, а также абсолютное количество Ароматазы являются факторами в широком различии эффектов EQ на эстрогенность.
- Управление эстрогенностью.
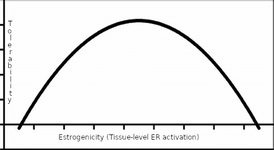
Рисунок: Упрощенная модель – кривая в форме буквы U.
Ось x связана с активацией эстрогенных рецепторов на уровне тканей, которая может не отражаться в концентрациях эстрогенов в крови. Ось y отражает переносимость. Область под кривой на её крайних точках (слишком низкая или слишком высокая) характеризуется как непереносимая. Таким образом, управление эстрогенностью является "проблемой Златовласки". Эстрогенность не должна быть слишком низкой или слишком высокой, она должна быть "как раз" с точки зрения переносимости.
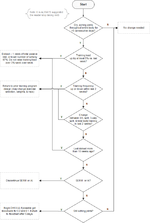
Следующий раздел практический – блок-схема принятия решений, к которой пользователь может обратиться при подозрении на низкую эстрогенность ("уронили E2").
- Практическая часть – Блок-схема принятия решений для решения проблемы низкой эстрогенности от использования EQ и/или Примы.
- Заключение.
- Исследования используемые автором:
[2] Junkmann, K, Suchowsky, G. [Research on anabolic-active steroids]. Arzneimittelforschung. 1962 Mar;12:214-8. German. PMID: 14452833.
[3] Trams, G. (1977). Effect of drostanolone propionate on the binding of oestradiol and dihydrotestosterone by normal and malignant target tissues. European Journal of Cancer (1965), 13(2), 149–153. doi:10.1016/0014-2964(77)90193-1
[4] Kalicharan, R. W., Bout, M. R., Oussoren, C., and Vromans, H. (2016). Where does hydrolysis of nandrolone decanoate occur in the human body after release from an oil depot? International Journal of Pharmaceutics, 515(1-2), 721–728. doi:10.1016/j.ijpharm.2016.10.068
[5] Gual, C., Morato, T., Hayano, M., Gut, M., and Dorfman, R. I. (1962). Biosynthesis of Estrogens. Endocrinology, 71(6), 920–925. doi:10.1210/endo-71-6-920
[6] Houtman, C. J., Sterk, S. S., van de Heijning, M. P. M., Brouwer, A., Stephany, R. W., van der Burg, B., and Sonneveld, E. (2009). Detection of anabolic androgenic steroid abuse in doping control using mammalian reporter gene bioassays. Analytica Chimica Acta, 637(1-2), 247–258. doi:10.1016/j.aca.2008.09.037
[7] Thomas MP, Potter BV. The structural biology of oestrogen metabolism. J Steroid Biochem Mol Biol. 2013;137:27-49. doi:10.1016/j.jsbmb.2012.12.014
[8] P. Niravath, Aromatase inhibitor-induced arthralgia: a review, Annals of Oncology, Volume 24, Issue 6, 2013, Pages 1443-1449, ISSN 0923-7534, doi.org/10.1093/annonc/mdt037.
[9] Cooke PS, Nanjappa MK, Ko C, Prins GS, Hess RA. Estrogens in Male Physiology. Physiol Rev. 2017 Jul 1;97(3):995-1043. doi:10.1152/physrev.00018.2016.
[10] Rubinow KB. Estrogens and Body Weight Regulation in Men. Adv Exp Med Biol. 2017;1043:285-313. doi:10.1007/978-3-319-70178-3_14
[11] Chidi-Ogbolu N, Baar K. Effect of Estrogen on Musculoskeletal Performance and Injury Risk. Front Physiol. 2019;9:1834. Published 2019 Jan 15. doi:10.3389/fphys.2018.01834
[12] Veldhuis, J. D., and Bowers, C. Y. (2003). Human GH pulsatility: An ensemble property regulated by age and gender. Journal of Endocrinological Investigation, 26(9), 799–813. doi:10.1007/bf03345229
[13] Chanson, P., Arnoux, A., Mavromati, M., Brailly-Tabard, S., Massart, C., … Young, J. (2016). Reference Values for IGF-I Serum Concentrations: Comparison of Six Immunoassays. The Journal of Clinical Endocrinology and Metabolism, 101(9), 3450–3458. doi:10.1210/jc.2016-1257
[14] Cook, D. M., Ludlam, W. H., and Cook, M. B. (1999). Route of Estrogen Administration Helps to Determine Growth Hormone (GH) Replacement Dose in GH-Deficient Adults1. The Journal of Clinical Endocrinology and Metabolism, 84(11), 3956–3960. doi:10.1210/jcem.84.11.6113
[15] He, W., Gauri, M., Li, T., Wang, R., and Lin, S.-X. (2016). Current knowledge of the multifunctional 17β-hydroxysteroid dehydrogenase type 1 (HSD17B1). Gene, 588(1), 54–61. doi:10.1016/j.gene.2016.04.031
[16] Thomas MP, Potter BV. The structural biology of oestrogen metabolism. J Steroid Biochem Mol Biol. 2013;137:27-49. doi:10.1016/j.jsbmb.2012.12.014
[17] Gual, C., Morato, T., Hayano, M., Gut, M., and Dorfman, R. I. (1962). Biosynthesis of Estrogens. Endocrinology, 71(6), 920–925. doi:10.1210/endo-71-6-920
[18] Lakshman, K. M., Kaplan, B., Travison, T. G., Basaria, S., Knapp, P. E., Singh, A. B., … Bhasin, S. (2010). The Effects of Injected Testosterone Dose and Age on the Conversion of Testosterone to Estradiol and Dihydrotestosterone in Young and Older Men. The Journal of Clinical Endocrinology and Metabolism, 95(8), 3955–3964. doi:10.1210/jc.2010-0102
[19] Fouad Mansour M, Pelletier M, Boulet MM, Mayrand D, Brochu G, Lebel S, Poirier D, Fradette J, Cianflone K, Luu-The V, Tchernof A. Oxidative activity of 17β-hydroxysteroid dehydrogenase on testosterone in male abdominal adipose tissues and cellular localization of 17β-HSD type 2. Mol Cell Endocrinol. 2015 Oct 15;414:168-76. doi: 10.1016/j.mce.2015.06.016. Epub 2015 Jun 26.
[20] Attardi BJ, Pham TC, Radler LC, Burgenson J, Hild SA, Reel JR. Dimethandrolone (7alpha,11beta-dimethyl-19-nortestosterone) and 11beta-methyl-19-nortestosterone are not converted to aromatic A-ring products in the presence of recombinant human aromatase. J Steroid Biochem Mol Biol. 2008;110(3-5):214-222. doi:10.1016/j.jsbmb.2007.11.009
[21] Thomas MP, Potter BV. The structural biology of oestrogen metabolism. J Steroid Biochem Mol Biol. 2013;137:27-49. doi:10.1016/j.jsbmb.2012.12.014
[22] Ellis, J. A., Stebbing, M., and Harrap, S. B. (2001). Significant Population Variation in Adult Male Height Associated with the Y Chromosome and the Aromatase Gene. The Journal of Clinical Endocrinology and Metabolism, 86(9), 4147–4150. doi:10.1210/jcem.86.9.7875