Великий и ужасный бета-амилоид
Давно известно, что важная часть патофизиологии болезни Альцгеймера (БА), основного типа деменции, - это накопление пептидов бета-амилоидов, сокращенно Aβ. Их функция в организме неизвестна, и рассматриваются они как фактор нейродегенерации. Наиболее нейротоксичным анаболическим стероидом принято считать тренболон, благодаря его ассоциации с бета-амилоидами, способность накапливать которые он продемонстрировал в исследовании: https://pubmed.ncbi.nlm.nih.gov/25461682/Но отношение к патогенезу болезни Альцгеймера и отложению этих пептидов имеет далеко не только тренболон, но даже и обычный тестостерон в супрафизиологических дозировках: https://pubmed.ncbi.nlm.nih.gov/18780973/
Как так получается, и какие процессы должен запускать андроген, чтобы вызывать отложение бета-амилоидов, мы разберемся в этой статье.
Сперва важно прояснить, что в патогенезе БА бета-амилоиды играют хоть и важную, но не единственную центральную роль. Гиперфосфолированный тау и его клубки (tangles) играет в токсичности амилоидного каскада бОльшую роль, чем сами бета-амилоиды и бляшки/олигомеры, так как в отсутствии тау нейроны не воспринимают вреда от Aβ.
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC122954/
Уменьшение тау прямым образом влияет на снижение нейродисфункции, вызываемой бета-амилоидами и эксайтотоксинами от гиперактивации NMDA рецепторов.
https://pubmed.ncbi.nlm.nih.gov/17478722/
https://pubmed.ncbi.nlm.nih.gov/20655099/
В исследовании ниже показано, как тау прямым образом влияет на амилоидогенный процесс, влияя как на количество фосфолированного (активированного) APP (белкапредшественника бета-амилоида), так и бета-секретазы 1, катализирующей амилоидогенез из APP.
https://pubmed.ncbi.nlm.nih.gov/23026200/
При этом, когда ген мутантного тау скрещивается с геном мутантного APP, процесс нейродегенерации значительно ускоряется
https://pubmed.ncbi.nlm.nih.gov/11520987/
https://pubmed.ncbi.nlm.nih.gov/16125396/
Разберем один из возможных механизмов на примере нандролона.
Нандролон влияет на транспортер глутамата GLT-1 и на его обратный захват, соответственно, уменьшая клиренс глутамата и повышая его содержание.
https://pubmed.ncbi.nlm.nih.gov/24937439/
Вероятно это происходит из-за роста уровня активных форм кислорода (АФК), потому что оксиданты показывают способность ингибировать обратный захват глутамата, а антиоксиданты восстанавливают его нормальный транспорт.
https://pubmed.ncbi.nlm.nih.gov/8626378/
https://pubmed.ncbi.nlm.nih.gov/9537835/
https://pubmed.ncbi.nlm.nih.gov/9215707/
https://pubmed.ncbi.nlm.nih.gov/9276486/
Рост глутамата означает снижение фермента PP2A (фосфатаза 2А).
https://pubmed.ncbi.nlm.nih.gov/18089844/
Роль PP2A - дефосфолирование ф-тау. Таким образом, становится очевидным следующий каскад:
- 1). увеличение уровня оксидантов, вызванное супрафизиологическими дозировками ААС
- 2). ингибирование способности глутаматного транспортера осуществлять обратный захват
- 3). рост уровня глутамата
- 4). снижение PP2A
- 5). рост уровня фосфолированного тау
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4165578/
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC3652076/
https://pubmed.ncbi.nlm.nih.gov/25700020/
https://pubmed.ncbi.nlm.nih.gov/27011054/
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC5864976/
НАДФН-оксидаза катализирует окисление НАДФН до НАДФ с образованием супероксидного радикала. Фермент эпимераза использует НАДФН как кофактор для синтеза сцилло-инозитола, таким образом, с истощением НАДФН при использовании ААС наблюдается снижение уровня сцилло-инозитола.
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4458166/
Сцилло-инозитол предотвращает склеивание и накопление бета-амилоидов. Более того, он препятствует гиперфосфолированию тау. Сцилло-инозитол и разработка его аналогов рассматривается как потенциальное лекарство для болезни Альцгеймера.
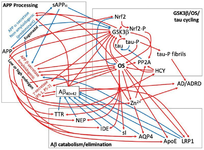
Другой важный фермент, участвующий в формировании амилоидных бляшек и тау клубков - киназа гликогенсинтазы-3-бета (GSK3β). Рост уровня этого фермента наблюдается при болезни Альцгеймера. GSK3β ингибирует активность редокс-чувствительного транскрипционного фактора Nrf2, который обеспечивает защиту клеток от окислительного стресса. Сам по себе избыточный окислительный стресс увеличивает экспрессию GSK3β, тем самым создавая условия для еще большего окислительного стресса. GSK3β повышает продукцию бета-амилоидов из APP;
https://pubmed.ncbi.nlm.nih.gov/14651959/
А также запускает гиперфосфолирование тау.
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC122157/
А Nrf2, напротив, снижает уровни ф-тау.
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC3990284/
Анаболические стероиды в супрафизиологических дозировках снижают активность Nrf2.
https://pubmed.ncbi.nlm.nih.gov/26187709/
Андрогены и окислительный стресс изменяют экспрессию многих белков, вовлеченных в регуляцию амилоидогенеза, образование ф-тау и их устранения, включая амилоидогенные ферменты бета- и гамма-секретазы.
В нормальных условиях APP под действием альфа-секретазы катаболизируется до растворимого α-APP, который не амилоидогенен и нейропротективен. Окислительный стресс уменьшает активность альфа-секретазы и увеличивает активность бета-секретазы, приводя к большим уровням мРНК бета-секретазы и бета-амилоидов. Бета-амилоиды сами по себе увеличивают окислительный стресс и повышают активность GSK-3β, приводя к формированию амилоидных бляшек, гиперфосфолированию тау и ингибированию Nrf2.
Гамма-секретаза - комплекс белков, вовлеченных в образование бета-амилоидов. Избыточный окислительный стресс и GSK3β повышают активность гамма-секретазы.
Транстиретин - транспортный белок, который образует комплексы с бета-амилоидами и помогает их устранить. Он наиболее эффективно образует комплексы с мономерами и олигомерами и устраняет их путем сборки в тетрамеры, образование, которое ингибируется избыточным окислительным стрессом. Таким образом, чем выше уровень оксидантов, тем ниже способность транстиретина устранять бета-амилоиды.
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC3604100/
Неприлизин - фермент, катаболизирующий растворимые Aβ40 и растворимые и нерастворимые Aβ42. Окислительный стресс ингибирует его активность.
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC6451684/
Также окислительный стресс ингибирует активность другого фермента, ответственного за катаболизм бета-амилоидов - фермента, разрушающий инсулин (IDE).
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4670075/
Аквапорин 4 — белок, представитель семейства аквапоринов, образующих водопроводящие каналы в клеточных мембранах. Он вовлечен в движение жидкости в лимфатической системе, которое участвует в клиренсе Aβ. Избыточный стресс высвобождает ионы цинка, которые ингибируют функцию канала аквапорина 4.
https://pubmed.ncbi.nlm.nih.gov/19928950/
Повышенный уровень цинка наблюдался в амилоидных бляшках больных Альцгеймером после вскрытия.
https://pubmed.ncbi.nlm.nih.gov/10678753/
Протеинфосфатаза 2А (PP2A) дефосфорилирует и регулирует активность ряда белков, включая ф-тау и GSK3β. Помимо избытка глутамата, избыточный окислительный стресс также ингибирует PP2A.
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC2848511/
Прооксидантная молекула гомоцистеина ингибирует PP2A, уровень которой повышен при злоупотреблении ААС.
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC6672573/
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC2564318/
Высокий уровень гомоцистеина стремительно повышает уровень ф-тау.
https://pubmed.ncbi.nlm.nih.gov/18007203/
Аполипопротеин E - транспортный белок, который связывается и устраняет бета-амилоиды. Окислительный стресс снижает уровень алипопротеина Е и захват бета-амилоидов, приводя к их аккумуляции.
https://pubmed.ncbi.nlm.nih.gov/28003160/
Белок 1, подобный рецептору липопротеинов низкой плотности (LPR1) выводит бета-амилоиды, транспортируя их из мозга в кровь и из кровотока в печень для устранения. LPR1 также изменяет локализацию бета-секретазы и усиливает её деградацию. Окислительный стресс и воспаление снижают транспортную активность LPR1 в отношении бета-амилоидов, а антиоксиданты ее усиливают.
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC3434291/
Наглядные схемы с взаимодействием белков и ферментов можно найти в этом обзоре.
Таким образом, во многом благодаря избытку окислительного стресса, анаболические стероиды в супрафизиологических дозировках вмешиваются во множество систем и путей в организме, регулирующих образование, аккумуляцию и устранение бета-амилоидов, их бляшек и олигомеров и фосфолированного тау белка. Злоупотребление ими может запустить каскад нейродегенеративных процессов, ускорив развитие болезней на несколько десятков лет.
Последнее редактирование: