
Многие пищевые продукты и содержащиеся в них макро- и микронутриенты способствуют профилактике сердечно-сосудистых, нейродегенеративных, воспалительных заболеваний, диабета, миопатий, а также профилактике осложнений в результате облучения. При многих из указанных патологий ухудшение структуры и функции мышечной ткани играет значительную роль в прогрессировании симптомов указанных заболеваний. Отсутствие специфической фармакотерапии нарушений в мышечной ткани при алиментарно-зависимых заболеваниях дает основание полагать, что нутритивная поддержка является важным компонентом в профилактике и терапии функциональной активности мышечной ткани. Учитывая особенности биохимических процессов в мышечной ткани, не удивительно, что в последние годы исследование роли L-карнитина (холиноподобный четвертичный амин, открытый двумя русскими исследователями В.С. Гулевичем и Р. Кринбергом в 1905 г.) привлекает значительное внимание ученых различных специальностей.Роль многих нутриентов в поддержании здоровья, увеличении продолжительности жизни хорошо известна.
L-карнитин играет важную роль в подавлении воспалительных реакций, окислительного стресса и апоптоза, ишемической болезни сердца. Продолжительный прием карнитина стимулирует окисление пирувата, что способствует ремоделлингу миокарда и улучшает функции миокарда, при этом устраняются мембранные дисфункции митохондрий, подавляется возникший окислительный стресс.
Современный спорт высших достижений требует от спортсмена проявления максимума физиологических возможностей, но при этом дает минимум времени и возможностей для полноценного восстановления. При напряженном графике интенсивных тренировок естественные процессы восстановления функций организма находятся под постоянным давлением прогрессивно нарастающего утомления. Работоспособность в видах спорта, требующих развития аэробной выносливости, во многом зависит от возможностей системы доставки и удаления продуктов энергетического метаболизма, а также окислительного потенциала рабочих мышц и доступности энергосубстратов (углеводов и липидов). Углеводные запасы при субмаксимальной аэробной работе могут обеспечивать выполнение упражнения в течение 80–90 мин. Поэтому в видах спорта, где соревновательное упражнение длится дольше (марафон, лыжные гонки, велоспорт и др.), особенно остро стоит проблема доступности жировых субстратов.
Анализ литературы позволяет констатировать, что до настоящего времени еще не сформированы представления о нормативных показателях иммунофизиологических параметров для представителей профессионального спорта. Также важнейшей проблемой и по сей день остается обеспечение организма энергетическими веществами и полноценное удаление метаболитов.
В контексте подобных проблем возникает физиологически обоснованная потребность в применении недопинговых эргогенных средств коррекции метаболических нарушений, которые призваны активизировать и сократить время адаптационных реакций организма к прогрессивно нарастающим тренировкам.
Роль карнитина в метаболизме
L-карнитин — это аминокислотный дериват, играющий эссенциальную роль в клеточном метаболизме путем ацилирования его β-гидроксильной группы.L-карнитин поступает в организм с пищей животного происхождения и накапливается в основном в мышечной ткани – до 95% всего потребляемого карнитина, в связи с этим его дефицит в первую очередь отражается на мышечной активности. Биологически активным является природный L-стереоизомер карнитина, поэтому в качестве пищевой добавки или лекарственного препарата должен применяться только L-карнитин.
Необходимо отметить, что предупреждение мышечных нарушений, вызванных в первую очередь высокими физическими нагрузками, обусловлено антиоксидантной активностью L-карнитина. При этом роль L-карнитина не ограничивается только участием в энергетическом обмене мышц. По сути он обеспечивает высокий фармакотерапевтический эффект при повреждении мышечной ткани.
В организме человека и животных L-карнитин синтезируется преимущественно в печени и почках путем трансформации лизина и метионина при участии витаминов С, В3, В6, фолиевой кислоты, железа, ряда аминокислот и ферментов. Основная его функция заключается в переносе длинноцепочечных жирных кислот из цитозоля в митохондриальный матрикс, где происходит их β-окисление до ацетил-КоА, который является субстратом для образования АТФ в цикле Кребса.
Жирные кислоты с короткой и средней длиной цепи (от 4 до 12 атомов углерода) могут проникать в матрикс митохондрий путем диффузии.
Жирные кислоты с длинной цепью, которые преобладают в организме человека (от 12 до 20 атомов углерода), активируются ацил-КоА-синтетазой, расположенной на внешней мембране митохондрий, при участии ионов магния и АТФ. Эти ферменты катализируют реакцию, в ходе которой возникает тиоэфирная связь между карбоксильной группой жирной кислоты и тиоловой группой кофермента А, т.е. образуется СоА – производное жирной кислоты; одновременно АТФ расщепляется на АМФ и неорганический фосфат.
Образовавшийся длинноцепочечный ацил-СоА (ДЦАСоА) катализируется ферментом карнитинацилтрансферазой I на внешней поверхности внутренней мембраны с образованием ацилкарнитина, который переносятся через внутреннюю митохондриальную мембрану с помощью транспортного белка – карнитинацилтранслоказы (см. рисунок) [8]. На внутренней поверхности внутренней мембраны митохондрий фермент карнитинацилтрансфераза II катализирует перенос ацила на внутримитохондриальный СоА с образованием ацил-СоА, который в процессе β-окисления превращается в ацетил-СоА, участвующий в цикле трикарбоновых кислот [8]. Свободный карнитин возвращается на внешнюю сторону внутренней мембраны митохондрий той же транслоказой.
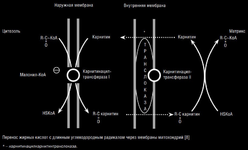
Cчитается, что данным путем в митохондрии поступают преимущественно длинноцепочечные жирные кислоты.
Помимо функции переносчика жирных кислот, карнитин также модулирует соотношение ацил-СоА/СоАSH, поддерживает пул свободного CoA, который необходим для функционирования пируватдегидрогеназы, α-кетоглутаратдегидрогеназы и, следовательно, для работы ЦТК.
Снижение поступления карнитина вызывает уменьшение содержания СоА в матриксе и сопутствующее этому повышение соотношения ацил-СоА/СоАSH, что вызывает ингибирование ферментативной активности упомянутых выше дегидрогеназ. Следовательно, ослабляется не только окисление жирных кислот, но и утилизация углеводов, катаболизм некоторых аминокислот, дезинтоксикация цитотоксических органических кислот и ксенобиотиков.
Важна экспрессия миогенных регуляторных факторов Myf5 и MyoD, вызванная карнитином, что приводит к торможению прогрессирования процессов ранней дифференцировки незрелых мышечных клеток. Кроме того, карнитин способствует экспрессии миогенных регуляторных факторов, таких как миогенин и скелетно-мышечный белок MyHC, который модулирует IGF-1/AKT/p70S6 сигнальные пути. Это свойство способствует ингибированию экспрессии таких белков, как MuRF1 и атрогина-1, – факторов, вовлеченных в убиквитин-протеасомную систему (UPS – ubiquitin proteasome system), регулирующую механизмы белковой деградации. Поступление с пищей карнитина способствует подавлению экспрессии генов, модулирующих высвобождение IGF-1 – ингибитора UPS.
Также L-карнитин сохраняет целостность мембран, стабилизирует иммунную систему, способствует более экономному расходованию запасов гликогена и глюкозы в период продолжительных интенсивных тренировок, участвует в обмене кетоновых тел и холинов, подавляет образование лактата и процессы апоптоза.
Клинические эффекты L-карнитина
Включение L-карнитин в диету способствует эффективному удалению биогенных шлаков и ксенобиотиков, а также предотвращает образование метаболитов жирных кислот, снижает уровень общего холестерина и триглицеридов, повышает содержание липопротеидов высокой плотности. Выявлена способность карнитина корригировать повреждающее действие свободных радикалов. Применение L-карнитина способствует устранению функциональных нарушений нервной системы. В исследовании, проведенном с участием больных с синдромом Альцгеймера в России и в ряде европейских стран, был установлен положительный эффект в отношении когнитивных функций. Так, длительное применение L-карнитина может отсрочить и/или замедлить прогрессирование болезни Альцгеймера. В настоящее время представляет интерес изучение терапевтической эффективности комбинаций антихолинэстеразных препаратов и L-карнитина при лечении этой болезни.Исключительный интерес вызывает способность L-карнитина предотвращать индукцию апоптоза. В эксперименте было показано, что его введение в кардиомиоциты, в которых апоптоз был вызван действием диструбицина, снижает внутриклеточный уровень церамида. Апоптический эффект L-карнитина может быть объяснен способностью ингибировать активность каспаз-3 и каспаз-8.
Потребность в L-карнитине достаточно индивидуальна, и, в отличие от большинства известных витаминов, не существует официально утвержденной нормы его потребления. Ученые-диетологи США пришли к заключению, что норма потребления карнитина должна составлять 20 мг на 1 кг массы тела. Очевидно, что приведенные нормы имеют усредненный характер, так как потребность организма в L-карнитине зависит от возраста человека и значительно повышается (в 4–20 раз) при умственных, физических и эмоциональных нагрузках, заболеваниях и особых функциональных состояниях (стресс, беременность, кормление грудью, спорт и др.).
Основным источником L-карнитина являются мясомолочные продукты. Эндогенный синтез обеспечивает потребность организма человека в карнитине лишь на 10–25%.
Таким образом, дефицит синтеза и низкий уровень содержания в пище данного микронутриента, особенно у новорожденных, приводят к карнитиновой недостаточности с многообразными системными проявлениями. Первичная карнитиновая недостаточность – тяжелая и редкая патология, обусловленная генетически детерминированным дефектом транспорта карнитина, что проявляется резкой мышечной слабостью и гипотонией, тяжелой кардиомиопатией, жировой дистрофией печени и почек.
Вторичная карнитиновая недостаточность встречается гораздо чаще и может быть вызвана пониженным синтезом L-карнитина при нарушении функции почек или печени; его высокой потерей при гемодиализе; уменьшении его всасывания при синдроме мальабсорбции; сниженной способностью к запасу L-карнитина у недоношенных новорожденных; приемом препаратов (азидотимидина, вальпроевой кислоты); низким содержанием карнитина в пищевых продуктах при вегетарианстве и парентеральном питании и т.д. Недостаточность карнитина выявлена при ряде форм наследственной патологии (синдромах Ретта, Марфана, Элеса–Данло и др.). Вторичная карнитиновая недостаточность особенно быстро формируется у детей и подростков, поскольку эндогенные запасы карнитина у них крайне ограничены и быстро истощаются.
Благодаря участию в универсальных биохимических процессах L-карнитин нашел применение в различных областях медицины: кардиологии, акушерстве, гинекологии, перинатологии, педиатрии, нефрологии, хирургии, иммунологии, аллергологии, офтальмологии, неврологии, психиатрии, профилактической медицине, дерматологии и косметологии.
Дополнительный прием L-карнитина, в сочетании с противодиабетической терапией, улучшает гликемический контроль при сахарном диабете 2 типа, снижает риск кардиоваскулярных нарушений путем снижения уровня холестерина липопротеинов низкой плотности и липопротеина.
Экспериментально было показано, что введение L-карнитина (6 г/сут) в течение 12 мес. пациентам с диагнозом «острый инфаркт миокарда» в 36 кардиологических центрах Италии привело к улучшению деятельности сердечно-сосудистой системы, в частности к уменьшению систолического и диастолического объема, что, вероятно, является следствием его участия в переносе жирных кислот, которые служат первоначальным субстратом энергии для кардиомиоцитов.
Результаты российских клинических исследований недоношенных новорожденных выявили улучшение физического и психомоторного развития на фоне приема L-карнитина, что свидетельствует о перспективности его использования в комплексной терапии в кардиологии. Так, у детей с признаками дистрофии миокарда на ранних стадиях была отмечена нормализация диастолической функции левого желудочка, при комплексной терапии с включением L-карнитина в дозе 30 мг/кг в сутки в течение 1 мес.
Проведенное обследование 42 новорожденных с транзиторной ишемией миокарда в возрасте от 7 до 28 дней выявило, что систематический прием L-карнитина в дозе 50–100 мг на 1 кг массы тела в 2–3 приема курсом от 14 до 28 дней способствует уменьшению бледности и цианоза кожи, восстановлению звучности сердечных тонов, исчезновению нарушений ритма сердца, сокращению размеров печени, исчезновению отеков, уменьшению частоты синусовых тахикардий. Таким образом, положительное влияние L-карнитина на течение инфаркта миокарда обусловлено как улучшением энергетического метаболизма, так и уменьшением зоны ишемических поражений. Это открывает новые возможности применения L-карнитина для лечения ишемической болезни сердца и инфаркта миокарда.
Аналогичный опыт использования L-карнитина при противоишемической терапии обобщен в работах зарубежных ученых. Клинические исследования продемонстрировали высокую эффективность средств, содержащих L-карнитин, в лечении сердечно-сосудистой патологии и профилактике их осложнений.
По мнению ведущих российских кардиологов, его применение обязательно должно входить в комплексную терапию сердечной недостаточности у больных с различными видами кардиомиопатий.
* Таблица модифицирована из статьи Н. Karlic и соавторы

Эффективность L-карнитина при физических нагрузках
В последние 30 лет отмечается заметное повышение числа научных публикаций по изучению роли L-карнитина в обмене веществ. К 2004 г. имелось уже более 10 000 научных сообщений и ежегодно публикуется около 300 работ по изучению свойств и эффектов L-карнитина. В течение многих лет L-карнитин входит в состав биологически активных добавок, используемых в спорте высоких достижений.Однако наибольшую перспективу представляет применение L-карнитина при интенсивной физической нагрузке. В спортивной практике он зарекомендовал себя как достаточно эффективное недопинговое анаболическое средство, способное предотвращать накопление избыточного количества молочной кислоты в мышцах, которое рассматривают как главную причину утомляемости.
Потребность организма спортсмена в экзогенном поступлении L-карнитина многократно увеличивается в условиях повышенной физической нагрузки, что можно устранить применением препаратов, содержащих его природные аналоги.
Избыточное накопление в митохондриях ацил-CoAs в условиях повышенной физической нагрузки ведет к угнетению скорости ферментозависимых процессов окислительного метаболизма в различных тканях организма. Карнитин способен принимать ацильные группы для превращения в ацетил-карнитин, эффективно снижая уровень ацил-CoA и расширяя возможность для продолжения упражнений с высокой интенсивностью. Этот процесс ограничен уровнем L-карнитина в мышцах, который постепенно уменьшается с продолжением интенсивных упражнений. Таким образом, уровни L-карнитина в мышцах ассоциируются со способностью поддерживать высокий уровень аэробного окисления при низком уровне продукции молочной кислоты.
Cледовательно, с теоретических позиций использование L-карнитина позволяет уменьшить долю анаэробного лактатного энергообразования и увеличить вклад более эффективной аэробной энергопродукции, повышая активность дыхательной цепи в мышцах и работоспособность в условиях интенсивных физических нагрузок. Он способствует уменьшению признаков физического и психического перенапряжения, стимулирует работоспособность, повышает аппетит и оказывает кардио-, гепато-, нейропротекторное действие, обладает иммуностимулирующими свойствами.
Мысль о целесообразности применения L-карнитина при подготовке спортсменов высказывалась отечественными учеными. Однако глубокое теоретическое и практическое обоснование данному вопросу было дано в зарубежных исследованиях. Так, в нескольких независимых исследованиях, включавших в общей сложности 350 человек (см. таблицу выше), выявлен положительный эффект карнитина при достаточно длительном его применении (не менее 1 мес в дозе около 3 г/сут).
Обследование юных футболистов сборной Мордовии, принимавших L-карнитин, выявило улучшение переносимости нагрузок, уменьшение чувства усталости и мышечной боли. Также установлено достоверное снижение биохимических маркеров повреждения миокарда (креатинфосфокиназы, лактатдегидрогеназы, тропонина I, кортизола).
Ряд исследований свидетельствует, что регулярное употребление L-карнитина не приводит к изменениям дыхательного коэффициента, работоспособности мышц и аккумуляции лактата у здоровых спортсменов, что, вероятно, можно объяснить индивидуальными отличиями спортсменов, и побуждает к дальнейшим исследованиям. Исследования, проведенные на базе Киевского национального университета физкультуры и спорта, свидетельствуют о повышении работоспособности и игровой выносливости волейболистов и баскетболистов, применявших L-карнитин, об уменьшении острых респираторных заболеваний у спортсменов.
Эффект от применения L-карнитина при интенсивной физической нагрузке был показан более чем в 300 исследованиях. Следует отметить, что наряду с этим L-карнитин способен ослаблять побочные эффекты интенсивных тренировок, снижая уровень гипоксии, способствует восстановлению мышц и активизирует иммунную систему. Новые данные об эффектах L-карнитина на иммунную систему, метаболические процессы, эндокринные функции представляют основу для дальнейших исследований системных эффектов его применения спортсменами.
L-карнитин и ТМАО
Избыток L-карнитина, а точнее одного из его метаболитов — триметиламин оксида, или ТМАО, может способствовать развитию атеросклероза.Два независимых исследования показали связь высоких концентраций ТМАО в плазме крови с развитием сердечной недостаточности, а также сердечнососудистых заболеваний в целом.L-карнитин, который человек употребляет с пищей, метаболизируется кишечной микробиотой до триметиламина, который всасывается в кишечнике и далее окисляется до ТМАО в печени.
Исследования на мышах также подтверждают корреляцию высокого уровня L-карнитина и ТМАО с развитием патологий сердечно-сосудистой системы. Так, у мышей, которые получали питание, обогащенное L-карнитином, во внутренней оболочке кровеносных сосудов активнее накапливался холестерин, из-за чего утолщался средний слой аорты — атеросклероз прогрессировал.
Хотя дело не в самом L-карнитине, а в кишечных бактериях, которые им питаются. Ведь именно за счёт них аминокислота превращается в «опасный» метаболит — ТМАО. Поэтому, если постоянно «подкармливать» микробиоту богатой L-карнитином пищей и добавками, то со временем ее состав изменится в сторону увеличения числа бактерий, способствующих синтезу ТМАО, а значит увеличится и риск развития атеросклероза.
Так, веганы и вегетарианцы, которые не употребляют красное мясо с высоким содержанием L-карнитина, больше защищены от атеросклероза, потому что в их микробиоте не развиваются бактерии, которые перерабатывают аминокислоту в «опасный» метаболит. При этом, даже при включении L-карнитина в рацион людей, придерживающихся исключительно растительной диеты, уровень ТМАО в плазме крови и моче все равно остается низким.
Как же избежать повышение уровней ТМАО?
Из описанного мной выше механизма делается очевидный вывод, что лишь пероральный прием левокарнитина будет сопровождаться образованием триметиламина. Как мы можем этого избежать? Верно, используя парентеральные методы его введения, допустим внутримышечно.
приоб$ести качественное инъекционное решение от Infinity Meds в хорошей концентрации для спортивных и терапевтических нужд можно тут. (превью)
Литература
1. Балыкова Л.А., Ивянский С. А., Пиксайкина О.А., Ефремова Ю.А. 22. Обоснование использования L-карнитина в спортивной медицине // Спортивная медицина: наука и практика. 2011. № 1. С. 22-29.
2. Брин И. Л. Элькар в педиатрической практике // Педиатрия. 2006. 23. № 3. С. 51-57.
3. Гунина М., Гуменюк Р.С., Парфенюк Н.С., Конончук Е. Н. Влияние коррекции гематологических показателей на физическую 24. работоспособность спортсменов // Спортивная медицина. 2009. № 1-2. С. 11-16. 25.
4. Кузин В. М. Карнитина хлорид (25 лет в клинической практике) // Русский медицинский журнал. Неврология, Психиатрия. 2003. № 10. С. 609-611. 26.
5. Леонтьева И.В., Белозеров Ю.М., Сухоруков В.С. и др. Диагностика и лечение митохондриальной дисфункции у детей: пособие для 27. врачей. М., 2001. С. 35.
6. Николаева Е. Элькар в практике педиатра // Врач. 2006. № 1. 28. С. 65-67.
7. Подкопай Д. О., Урдин В.Г. // Современная педиатрия. 2009. 29. 4(26).
8. Северин Е. С. Биохимия: учебник для вузов. М., 2003. С. 399-417.
9. Aartsma-Rus A., van Ommen G.J., Kaplan J. Innovating therapies for muscle diseases // Handbook of Clinical Neurology. North-Holland Publisher, 2013. Vol. 113. P. 1497-1501. 30.
10. Arenas J., Huertas R., Campos Y., Diaz A.E. et al. Effects of L-carnitine on the pyruvate dehydrogenase complex and carnitine palmitoyl 31. transferase activities in muscle of endurance athletes // FEBS Lett. 1994. Vol. 341, N 1. P. 91-3.
11. Arnold H.-H., Winter B. Muscle differentiation: more complexity to the network of myogenic regulators // Curr. Opin. Genet. Dev. 1998. 32. Vol. 8, N 5. P. 539-544.
12. Bodine S.C., Stitt T.N., Gonzalez M. et al. Akt/mTOR pathway is a crucial regulator of skeletal muscle hypertrophy and can prevent muscle atrophy in vivo // Nat. Cell Biol. 2001. Vol. 3, N 11. P. 1014-1019. 33.
13. Brass E.P. Supplemental carnitine and exercise // Am. J. Clin. Nutr. 2000. Vol. 72, suppl. P. 618s-623s.
14. Brown K.R., Goodband R.D., Tokach M.D. et al. Effects of feeding 34. L-carnitine to gilts through day 70 of gestation on litter traits and the expression of insulin-like growth factor system components and L-carnitine concentration in foetal tissues // J. Anim. Physiol. Anim. Nutr. 2008. Vol. 92, N 6. P. 660-667. 35.
15. Chang B., Nishikawa M., Sato E., Utsumi K. et al. L-carnitine inhibits cisplatin-induced injury of the kidney and small intestine // Arch. Biochem. Biophys. 2002. Vol. 405, N 1. P. 55-64. 36.
16. Daglia M., di Lorenzo A., Nabavi S.F., Talas Z.S. et al. Polyphenols: well beyond the antioxidant capacity: gallic acid and related compounds as neuroprotective agents: you are what you eat! // Curr. 37. Pharm. Biotechnol. 2014. Vol. 15, N 4. P. 362-372.
17. D’Antona G., Nabavi S.M., Micheletti P. et al. Creatine, L-carnitine, and polyunsaturated fatty acid supplementation from healthy to 38. diseased skeletal muscle // BioMed Res. Int. 2014, Vol. 2014. Article ID 613890.
18. Delaney C.L., Spark J.I., Thomas J., Wong Y.T. et al. A systematic review to evaluate the effectiveness of carnitine supplementation in 39. improving walking performance among individuals with intermittent claudication // Atherosclerosis. 2013. Vol. 229, N 1. P. 1-9.
19. Doberenz J., Birkenfeld C., Kluge H., Eder K. Effects of L-carnitine supplementation in pregnant sows on plasma concentrations of 40. insulin-like growth factors, various hormones and metabolites and chorion characteristics // J. Anim. Physiol. Anim. Nutr. 2006. Vol. 90,N 11-12. P. 487-499. 41.
20. Dutta A., Ray K., Singh V.K., Vats P. et al. L-carnitine supplementation attenuates intermittent hypoxia-induced oxidative stress and 42. delays muscle fatigue in rats // Exp. Physiol. 2008. Vol. 93, N 10.P. 1139-1146.
21. Flachs P., Rossmeisl M., Kopecky J. The effect of n-3 fatty acids on 43. glucose homeostasis and insulin sensitivity // Physiol. Res. 2014.Vol. 63. P. S93-S118.
22. Foletta V.C., White L.J., Larsen A.E., Leger B. et al. The role and regulation of MAFbx/atrogin-1 and MuRFI in skeletal muscle atrophy // Pflugers Arch. 2011. Vol. 461, N. 3. P. 325-335.
23. Garcia-Lafuente A., Moro C., Manchyn N. et al. In vitro antiinflammatory activity of phenolic rich extracts from white and red common beans // Food Chem. 2014. Vol. 161. P. 216-223.
24. Glass D.J. Signalling pathways that mediate skeletal muscle hypertrophy and atrophy // Nat. Cell Biol. 2003. Vol. 5, N 2. P. 87-90.
25. Gorostiaga E.M., Maurer C.A., Eclache J.P. Decrease in respiratory quotient during exercise following L-carnitine supplementation // Int. J. Sports Med. 1989. Vol. 10. P. 169-74.
26. Gulcin I. Antioxidant and antiradical activities of L-carnitine // Life Sci. 2006. Vol. 78, N 8. P. 803-811.
27. Gumucio J.P., Mendias C.L. Atrogin-1, MuRF-1, and sarcopenia // Endocrine. 2013. Vol. 43, N 1. P. 12-21.
28. Huang A., Owen K. Role of supplementary L-carnitine in exercise and exercise recovery // Med. Sport Sci. 2012. Vol. 59. P. 135-142.
29. Iliceto S., Scrutinio D., Bruzzi P., D’Ambrosio G. et al. Effects of L-carnitine administration on left ventricular remodeling after acute anterior myocardial infarction: the L-Carnitine Ecocardiografia Digitalizzata Infarto Miocardico (CEDIM) // Trial. J. Am. Coll. Cardiol. 1995. Vol. 26. P. 380-387.
30. Karlic H., Lohninger A. Supplementation of L-carnitine in athletes: does it make sense? // Nutrition. 2004. Vol. 20. P. 709-715.
31. Keller J., Couturier A., Haferkamp M., Most E. et al. Supplementation of carnitine leads to an activation of the IGF-1/PI3K/Akt signalling pathway and down regulates the E3 ligase MuRF1 in skeletal muscle of rats // Nutr. Metab. 2013. Vol. 10, N 1. P. 28.
32. Keller J., Ringseis R., Koc A., Lukas I. et al. Supplementation with l-carnitine downregulates genes of the ubiquitin proteasome system in the skeletal muscle and liver of piglets // Animal. 2012. Vol. 6, N 1. P. 70-78.
33. Keller J., Ringseis R., Priebe S., Guthke R. et al. Dietary L-carnitine alters gene expression in skeletal muscle of piglets // Mol. Nutr. Food Res. 2011. Vol. 55, N 3. P. 419-429.
34. Kita K., Kato S., Yaman M.A., Okumura J. et al. Dietary L-carnitine increases plasma insulin-like growth factor-I concentration in chicks fed a diet with adequate dietary protein level // Br. Poult. Sci. 2002. Vol. 43, N 1. P. 117-121.
35. Knight J.D.R., Kothary R. The myogenic kinome: protein kinases critical to mammalian skeletal myogenesis // Skeletal Muscle. 2011. Vol. 1, N 1. P. 29.
36. Kraemer W.J., Volek J.S., Dunn-Lewis, Courtenay. L-carnitine supplementation: influence upon physiological function // Curr. Sports Med. Rep. 2008. Vol. 7, is. 4. P. 218-223. Landi F., Marzetti E., Martone A.M., Bernabei R. et al. Exercise as a remedy for sarcopenia // Curr. Opin. Clin. Nutr. Metab. Care. 2014. Vol. 17, N 1. P. 25-31.
37. Landi F., Marzetti E., Martone A.M., Bernabei R. et al. Exercise as a remedy for sarcopenia. Curr Opin Clin Nutr Metab. Care. 2014; Vol. 17 (1): 25–31
38. Montesano A., Senesi P., Luzi L., Benedini S. et al. Potential therapeutic role of L-carnitine in skeletal muscle oxidative stress and atrophy conditions. Oxidative Med Cell Longev. 2015; Article ID 646171.
39. Noor Kadhim Mohammed-Jawad, May Al-Sabbagh, Kaiss A. AL-Jezaeri. Role of L-carnitine and coenzyme Q10 as adjuvant therapy in patients with type 2 diabetes mellitus // Am. J. Pharmacol. Sci. 2014. Vol. 2, N. 5. P. 82-86.
40. Nabavi S.M., Daglia M., Moghaddam A.H., Nabavi S.F. et al. Tea consumption and risk of ischemic stroke: a brief review of the literature // Curr. Pharm. Biotechnol. 2014. Vol. 15, N 4. P. 298-303.
41. Nuesch R., Rossetto M., Martina B. Influence of L-carnitine intake B. // Drugs Exp. Clin. Res. 1999. Vol. 25. P. 167.
42. Pekala J., Patkowska-Sokola B., Bodkowski R. et al. L-carnitine — metabolic functions and meaning in humans life. Curr Drug Metab. 2011; Vol. 12 (7): 167.
43. Perry R.L., Rudnick M.A. Molecular mechanisms regulating myo-genic determination and differentiation // Front. Biosci. 2000. Vol. 5. P. D750-D767.
44. Powers S.K., Kavazis A.N., McClung J.M. Oxidative stress and disuse muscle atrophy // J. Appl. Physiol. 2007. Vol. 102, N 6. P. 2389-2397.
45. Ringseis R., Keller J., Eder K. Mechanisms underlying the anti-wasting effect of L-carnitine supplementation under pathologic conditions: Evidence from experimental and clinical studies // Eur. J. Nutr. 2013. Vol. 52. P. 1421-1442.
46. Shug A.L., Shrago E. // J. Lab. Clin. Med. 1973. Vol. 81. P. 214218.
47. Siliprandi N., Di Lisa F., Menabo R. // Adv. Exp. Med. Biol. 1990. Vol. 272. P. 175.
48. Stanley W.C., Lopaschuk G.D., Hall J.L., McCormack J.G. Regulation of myocardial carbohydrate metabolism under normal and ischaemic conditions. Potential for pharmacological interventions // Cardiovasc. Res. 1997. Vol. 33. P. 243-247.
49. Suzuki Y., Kamikawa T., Kobayashi A., Yamazaki N. // Adv. Myocar-diol. 1983. Vol. 4. P. 549-557.
50. Thomsen J.H., Shug A.L. Yap V.U. et al. // Am. J. Cardiol. 1979. Vol. 43. P. 300-306.
51. Trappe S.W., Costill D.L., Goodpaster B., Vukovich M.D. et al. // Int. J. Sports Med. 1994. Vol. 15. P. 181.
52. Ueno Y., Koike M., Shimada Y., Shimura H. et al. L-carnitine enhances axonal plasticity and improves white-matter lesions after chronic hypoperfusion in rat brain // J. Cereb. Blood Flow Metab. 2015. Vol. 35, N 3. P. 382-391.
53. Vescovo G., Ravara B., Gobbo V. et al. // Am. J. Physiol. Cell. Physiol. 2002. Vol. 283. P. C802.
54. Virmani A., Diedenhofen A. The possible mechanisms involved in the protection strategies against radiation-induced cellular damage by carnitines // Int. J. Clin. Med. 2015. Vol. 6. P. 71-80.
55. Volek J.S., Kraemer W.J., Rubin M.R., Gymez A.L. et al. // Am. J. Physiol. Endocrinol. Metab. 2002. Vol. 282. P. E474-E482.
56. Wyss M., Kaddurah-Daouk R. Creatine and creatinine metabolism // Physiol. Rev. 2000. Vol. 80, N 3. P. 1107-1213.
References
1. Balykova L.A., Ivjanskij S.A., Piksajkina O.A., Efremova Yu.A. Rationale for the use of L-carnitine in sports medicine. Sportivnaya medit-sina: nauka i praktika [Sports Medicine: Research and Practice: Research and practical journal]. 2011; N 1: 22-9. (in Russian)
2. Brin I.L. Elcar in pediatric practice. Pediatriya [Pediatrics]. 2006; N 3: 51-7. (in Russian)
3. Gunina M., Gumenyuk R.S., Parfenyuk N.S., Kononchuk E.N. Effect of hematological parameters correction on the physical capacity of athletes. Sportivnaya meditsina: nauka i praktika [Sports Medicine: Research and Practice: Research and practical journal]. 2009; N 1-2: 11-6. (in Russian)
4. Kuzin V.M. Carnitine chloride (25 years in clinical practice). Russ-kiy meditsinskiy zhurnal. Nevrologiya, Psikhiatriya [Russian Medical Journal. Neurology. Psychiatry]. 2003; N 10: 609-11. (in Russian)
5. Leont’eva I.V., Belozerov Yu.M., Sukhorukov V.S. et al. Diagnosis and treatment of mitochondrial disorders in children: benefit for physicians. Moscow, 2001. (in Russian)
6. Nikolaeva E. Elcar in pediatrician’s practice. Vrach [The Doctor]. 2006; N 1: 65-7. (in Russian)
7. Podkopay D.O., Urdin V.G. On the question of poliprotectors usage in sports. Voprosy sovremennoi pediatrii [Current pediatrics]. 2009; 4 (26). (in Russian)
8. Severin E.S. Biochemistry: university textbook. Moscow, 2003; 399-417. (in Russian)
9. Aartsma-Rus A., van Ommen G.J., Kaplan J. Innovating therapies for muscle diseases. Handbook of Clinical Neurology. North-Holland Publisher, 2013; Vol. 113: 1497-501.
10. Arenas J., Huertas R., Campos Y., Diaz A.E. et al. Effects of L-carni-tine on the pyruvate dehydrogenase complex and carnitine palmitoyl transferase activities in muscle of endurance athletes. FEBS Lett. 1994; Vol. 341 (1): 91-3.
11. Arnold H.-H., Winter B. Muscle differentiation: more complexity to the network of myogenic regulators. Curr Opin Genet Dev. 1998; Vol. 8 (5): 539-44.
12. Bodine S.C., Stitt T.N., Gonzalez M. et al. Akt/mTOR pathway is a crucial regulator of skeletal muscle hypertrophy and can prevent muscle atrophy in vivo. Nat Cell Biol. 2001; Vol. 3 (11): 1014-9.
2. Брин И. Л. Элькар в педиатрической практике // Педиатрия. 2006. 23. № 3. С. 51-57.
3. Гунина М., Гуменюк Р.С., Парфенюк Н.С., Конончук Е. Н. Влияние коррекции гематологических показателей на физическую 24. работоспособность спортсменов // Спортивная медицина. 2009. № 1-2. С. 11-16. 25.
4. Кузин В. М. Карнитина хлорид (25 лет в клинической практике) // Русский медицинский журнал. Неврология, Психиатрия. 2003. № 10. С. 609-611. 26.
5. Леонтьева И.В., Белозеров Ю.М., Сухоруков В.С. и др. Диагностика и лечение митохондриальной дисфункции у детей: пособие для 27. врачей. М., 2001. С. 35.
6. Николаева Е. Элькар в практике педиатра // Врач. 2006. № 1. 28. С. 65-67.
7. Подкопай Д. О., Урдин В.Г. // Современная педиатрия. 2009. 29. 4(26).
8. Северин Е. С. Биохимия: учебник для вузов. М., 2003. С. 399-417.
9. Aartsma-Rus A., van Ommen G.J., Kaplan J. Innovating therapies for muscle diseases // Handbook of Clinical Neurology. North-Holland Publisher, 2013. Vol. 113. P. 1497-1501. 30.
10. Arenas J., Huertas R., Campos Y., Diaz A.E. et al. Effects of L-carnitine on the pyruvate dehydrogenase complex and carnitine palmitoyl 31. transferase activities in muscle of endurance athletes // FEBS Lett. 1994. Vol. 341, N 1. P. 91-3.
11. Arnold H.-H., Winter B. Muscle differentiation: more complexity to the network of myogenic regulators // Curr. Opin. Genet. Dev. 1998. 32. Vol. 8, N 5. P. 539-544.
12. Bodine S.C., Stitt T.N., Gonzalez M. et al. Akt/mTOR pathway is a crucial regulator of skeletal muscle hypertrophy and can prevent muscle atrophy in vivo // Nat. Cell Biol. 2001. Vol. 3, N 11. P. 1014-1019. 33.
13. Brass E.P. Supplemental carnitine and exercise // Am. J. Clin. Nutr. 2000. Vol. 72, suppl. P. 618s-623s.
14. Brown K.R., Goodband R.D., Tokach M.D. et al. Effects of feeding 34. L-carnitine to gilts through day 70 of gestation on litter traits and the expression of insulin-like growth factor system components and L-carnitine concentration in foetal tissues // J. Anim. Physiol. Anim. Nutr. 2008. Vol. 92, N 6. P. 660-667. 35.
15. Chang B., Nishikawa M., Sato E., Utsumi K. et al. L-carnitine inhibits cisplatin-induced injury of the kidney and small intestine // Arch. Biochem. Biophys. 2002. Vol. 405, N 1. P. 55-64. 36.
16. Daglia M., di Lorenzo A., Nabavi S.F., Talas Z.S. et al. Polyphenols: well beyond the antioxidant capacity: gallic acid and related compounds as neuroprotective agents: you are what you eat! // Curr. 37. Pharm. Biotechnol. 2014. Vol. 15, N 4. P. 362-372.
17. D’Antona G., Nabavi S.M., Micheletti P. et al. Creatine, L-carnitine, and polyunsaturated fatty acid supplementation from healthy to 38. diseased skeletal muscle // BioMed Res. Int. 2014, Vol. 2014. Article ID 613890.
18. Delaney C.L., Spark J.I., Thomas J., Wong Y.T. et al. A systematic review to evaluate the effectiveness of carnitine supplementation in 39. improving walking performance among individuals with intermittent claudication // Atherosclerosis. 2013. Vol. 229, N 1. P. 1-9.
19. Doberenz J., Birkenfeld C., Kluge H., Eder K. Effects of L-carnitine supplementation in pregnant sows on plasma concentrations of 40. insulin-like growth factors, various hormones and metabolites and chorion characteristics // J. Anim. Physiol. Anim. Nutr. 2006. Vol. 90,N 11-12. P. 487-499. 41.
20. Dutta A., Ray K., Singh V.K., Vats P. et al. L-carnitine supplementation attenuates intermittent hypoxia-induced oxidative stress and 42. delays muscle fatigue in rats // Exp. Physiol. 2008. Vol. 93, N 10.P. 1139-1146.
21. Flachs P., Rossmeisl M., Kopecky J. The effect of n-3 fatty acids on 43. glucose homeostasis and insulin sensitivity // Physiol. Res. 2014.Vol. 63. P. S93-S118.
22. Foletta V.C., White L.J., Larsen A.E., Leger B. et al. The role and regulation of MAFbx/atrogin-1 and MuRFI in skeletal muscle atrophy // Pflugers Arch. 2011. Vol. 461, N. 3. P. 325-335.
23. Garcia-Lafuente A., Moro C., Manchyn N. et al. In vitro antiinflammatory activity of phenolic rich extracts from white and red common beans // Food Chem. 2014. Vol. 161. P. 216-223.
24. Glass D.J. Signalling pathways that mediate skeletal muscle hypertrophy and atrophy // Nat. Cell Biol. 2003. Vol. 5, N 2. P. 87-90.
25. Gorostiaga E.M., Maurer C.A., Eclache J.P. Decrease in respiratory quotient during exercise following L-carnitine supplementation // Int. J. Sports Med. 1989. Vol. 10. P. 169-74.
26. Gulcin I. Antioxidant and antiradical activities of L-carnitine // Life Sci. 2006. Vol. 78, N 8. P. 803-811.
27. Gumucio J.P., Mendias C.L. Atrogin-1, MuRF-1, and sarcopenia // Endocrine. 2013. Vol. 43, N 1. P. 12-21.
28. Huang A., Owen K. Role of supplementary L-carnitine in exercise and exercise recovery // Med. Sport Sci. 2012. Vol. 59. P. 135-142.
29. Iliceto S., Scrutinio D., Bruzzi P., D’Ambrosio G. et al. Effects of L-carnitine administration on left ventricular remodeling after acute anterior myocardial infarction: the L-Carnitine Ecocardiografia Digitalizzata Infarto Miocardico (CEDIM) // Trial. J. Am. Coll. Cardiol. 1995. Vol. 26. P. 380-387.
30. Karlic H., Lohninger A. Supplementation of L-carnitine in athletes: does it make sense? // Nutrition. 2004. Vol. 20. P. 709-715.
31. Keller J., Couturier A., Haferkamp M., Most E. et al. Supplementation of carnitine leads to an activation of the IGF-1/PI3K/Akt signalling pathway and down regulates the E3 ligase MuRF1 in skeletal muscle of rats // Nutr. Metab. 2013. Vol. 10, N 1. P. 28.
32. Keller J., Ringseis R., Koc A., Lukas I. et al. Supplementation with l-carnitine downregulates genes of the ubiquitin proteasome system in the skeletal muscle and liver of piglets // Animal. 2012. Vol. 6, N 1. P. 70-78.
33. Keller J., Ringseis R., Priebe S., Guthke R. et al. Dietary L-carnitine alters gene expression in skeletal muscle of piglets // Mol. Nutr. Food Res. 2011. Vol. 55, N 3. P. 419-429.
34. Kita K., Kato S., Yaman M.A., Okumura J. et al. Dietary L-carnitine increases plasma insulin-like growth factor-I concentration in chicks fed a diet with adequate dietary protein level // Br. Poult. Sci. 2002. Vol. 43, N 1. P. 117-121.
35. Knight J.D.R., Kothary R. The myogenic kinome: protein kinases critical to mammalian skeletal myogenesis // Skeletal Muscle. 2011. Vol. 1, N 1. P. 29.
36. Kraemer W.J., Volek J.S., Dunn-Lewis, Courtenay. L-carnitine supplementation: influence upon physiological function // Curr. Sports Med. Rep. 2008. Vol. 7, is. 4. P. 218-223. Landi F., Marzetti E., Martone A.M., Bernabei R. et al. Exercise as a remedy for sarcopenia // Curr. Opin. Clin. Nutr. Metab. Care. 2014. Vol. 17, N 1. P. 25-31.
37. Landi F., Marzetti E., Martone A.M., Bernabei R. et al. Exercise as a remedy for sarcopenia. Curr Opin Clin Nutr Metab. Care. 2014; Vol. 17 (1): 25–31
38. Montesano A., Senesi P., Luzi L., Benedini S. et al. Potential therapeutic role of L-carnitine in skeletal muscle oxidative stress and atrophy conditions. Oxidative Med Cell Longev. 2015; Article ID 646171.
39. Noor Kadhim Mohammed-Jawad, May Al-Sabbagh, Kaiss A. AL-Jezaeri. Role of L-carnitine and coenzyme Q10 as adjuvant therapy in patients with type 2 diabetes mellitus // Am. J. Pharmacol. Sci. 2014. Vol. 2, N. 5. P. 82-86.
40. Nabavi S.M., Daglia M., Moghaddam A.H., Nabavi S.F. et al. Tea consumption and risk of ischemic stroke: a brief review of the literature // Curr. Pharm. Biotechnol. 2014. Vol. 15, N 4. P. 298-303.
41. Nuesch R., Rossetto M., Martina B. Influence of L-carnitine intake B. // Drugs Exp. Clin. Res. 1999. Vol. 25. P. 167.
42. Pekala J., Patkowska-Sokola B., Bodkowski R. et al. L-carnitine — metabolic functions and meaning in humans life. Curr Drug Metab. 2011; Vol. 12 (7): 167.
43. Perry R.L., Rudnick M.A. Molecular mechanisms regulating myo-genic determination and differentiation // Front. Biosci. 2000. Vol. 5. P. D750-D767.
44. Powers S.K., Kavazis A.N., McClung J.M. Oxidative stress and disuse muscle atrophy // J. Appl. Physiol. 2007. Vol. 102, N 6. P. 2389-2397.
45. Ringseis R., Keller J., Eder K. Mechanisms underlying the anti-wasting effect of L-carnitine supplementation under pathologic conditions: Evidence from experimental and clinical studies // Eur. J. Nutr. 2013. Vol. 52. P. 1421-1442.
46. Shug A.L., Shrago E. // J. Lab. Clin. Med. 1973. Vol. 81. P. 214218.
47. Siliprandi N., Di Lisa F., Menabo R. // Adv. Exp. Med. Biol. 1990. Vol. 272. P. 175.
48. Stanley W.C., Lopaschuk G.D., Hall J.L., McCormack J.G. Regulation of myocardial carbohydrate metabolism under normal and ischaemic conditions. Potential for pharmacological interventions // Cardiovasc. Res. 1997. Vol. 33. P. 243-247.
49. Suzuki Y., Kamikawa T., Kobayashi A., Yamazaki N. // Adv. Myocar-diol. 1983. Vol. 4. P. 549-557.
50. Thomsen J.H., Shug A.L. Yap V.U. et al. // Am. J. Cardiol. 1979. Vol. 43. P. 300-306.
51. Trappe S.W., Costill D.L., Goodpaster B., Vukovich M.D. et al. // Int. J. Sports Med. 1994. Vol. 15. P. 181.
52. Ueno Y., Koike M., Shimada Y., Shimura H. et al. L-carnitine enhances axonal plasticity and improves white-matter lesions after chronic hypoperfusion in rat brain // J. Cereb. Blood Flow Metab. 2015. Vol. 35, N 3. P. 382-391.
53. Vescovo G., Ravara B., Gobbo V. et al. // Am. J. Physiol. Cell. Physiol. 2002. Vol. 283. P. C802.
54. Virmani A., Diedenhofen A. The possible mechanisms involved in the protection strategies against radiation-induced cellular damage by carnitines // Int. J. Clin. Med. 2015. Vol. 6. P. 71-80.
55. Volek J.S., Kraemer W.J., Rubin M.R., Gymez A.L. et al. // Am. J. Physiol. Endocrinol. Metab. 2002. Vol. 282. P. E474-E482.
56. Wyss M., Kaddurah-Daouk R. Creatine and creatinine metabolism // Physiol. Rev. 2000. Vol. 80, N 3. P. 1107-1213.
References
1. Balykova L.A., Ivjanskij S.A., Piksajkina O.A., Efremova Yu.A. Rationale for the use of L-carnitine in sports medicine. Sportivnaya medit-sina: nauka i praktika [Sports Medicine: Research and Practice: Research and practical journal]. 2011; N 1: 22-9. (in Russian)
2. Brin I.L. Elcar in pediatric practice. Pediatriya [Pediatrics]. 2006; N 3: 51-7. (in Russian)
3. Gunina M., Gumenyuk R.S., Parfenyuk N.S., Kononchuk E.N. Effect of hematological parameters correction on the physical capacity of athletes. Sportivnaya meditsina: nauka i praktika [Sports Medicine: Research and Practice: Research and practical journal]. 2009; N 1-2: 11-6. (in Russian)
4. Kuzin V.M. Carnitine chloride (25 years in clinical practice). Russ-kiy meditsinskiy zhurnal. Nevrologiya, Psikhiatriya [Russian Medical Journal. Neurology. Psychiatry]. 2003; N 10: 609-11. (in Russian)
5. Leont’eva I.V., Belozerov Yu.M., Sukhorukov V.S. et al. Diagnosis and treatment of mitochondrial disorders in children: benefit for physicians. Moscow, 2001. (in Russian)
6. Nikolaeva E. Elcar in pediatrician’s practice. Vrach [The Doctor]. 2006; N 1: 65-7. (in Russian)
7. Podkopay D.O., Urdin V.G. On the question of poliprotectors usage in sports. Voprosy sovremennoi pediatrii [Current pediatrics]. 2009; 4 (26). (in Russian)
8. Severin E.S. Biochemistry: university textbook. Moscow, 2003; 399-417. (in Russian)
9. Aartsma-Rus A., van Ommen G.J., Kaplan J. Innovating therapies for muscle diseases. Handbook of Clinical Neurology. North-Holland Publisher, 2013; Vol. 113: 1497-501.
10. Arenas J., Huertas R., Campos Y., Diaz A.E. et al. Effects of L-carni-tine on the pyruvate dehydrogenase complex and carnitine palmitoyl transferase activities in muscle of endurance athletes. FEBS Lett. 1994; Vol. 341 (1): 91-3.
11. Arnold H.-H., Winter B. Muscle differentiation: more complexity to the network of myogenic regulators. Curr Opin Genet Dev. 1998; Vol. 8 (5): 539-44.
12. Bodine S.C., Stitt T.N., Gonzalez M. et al. Akt/mTOR pathway is a crucial regulator of skeletal muscle hypertrophy and can prevent muscle atrophy in vivo. Nat Cell Biol. 2001; Vol. 3 (11): 1014-9.

